
【題目】下列各物質(zhì)的分類、名稱(或俗名)、化學(xué)式都正確的是( )
A.酸性氧化物 干冰 CO2
B.堿 純堿 Na2CO3
C.酸 硫酸 H2SO3
D.單質(zhì) 氯水 Cl2
 名校課堂系列答案
名校課堂系列答案
| 年級(jí) | 高中課程 | 年級(jí) | 初中課程 |
| 高一 | 高一免費(fèi)課程推薦! | 初一 | 初一免費(fèi)課程推薦! |
| 高二 | 高二免費(fèi)課程推薦! | 初二 | 初二免費(fèi)課程推薦! |
| 高三 | 高三免費(fèi)課程推薦! | 初三 | 初三免費(fèi)課程推薦! |
科目:高中化學(xué) 來(lái)源: 題型:
【題目】Ⅰ.某溫度(t℃)時(shí),水的Kw=10-13,則該溫度(填 “大于”“小于”或“等于”)_________ 25℃,理由是_________,將此溫度下pH =11的NaOH溶液aL與pH=1的H2SO4溶液bL混合,
(1)若所得混合液為中性,則a∶b_________;
(2)若所得混合液的pH=2,則a∶b_________。
Ⅱ.25℃時(shí),0.1mol·L-1的某一元酸HA在水中有0.1%發(fā)生電離,下列說(shuō)法不正確的是(_____)
A.該溶液pH=4 B.由HA電離出的c(H+)約為水電離出的c(H+)的106倍
C.此酸的電離平衡常數(shù)約為1×10-7 D.升高溫度,溶液的pH增大
查看答案和解析>>
科目:高中化學(xué) 來(lái)源: 題型:
【題目】鹵族元索的單質(zhì)和化合物在生產(chǎn)生活中有重要的用途。
(1)基態(tài)溴原子的核外電子排布式為[Ar]_________。
(2)在一定濃度的HF溶液中,氟化氫是以締合形式(HF)2存在的。使氟化氫分子締合的作用力是_________。
(3)HIO3的酸性_________(填“強(qiáng)于”或“弱于”)HIO4,原因是_________。
(4)ClO2-中心氯原子的雜化類型為_________,ClO3-的空間構(gòu)型為_________。
(5)晶胞有兩個(gè)基本要素:①原子坐標(biāo)參數(shù):表示晶胞內(nèi)部各微粒的相對(duì)位置。下圖是CaF2的晶胞,其中原子坐標(biāo)參數(shù)A處為(0,0,0);B處為(![]() ,
, ![]() ,0);C處為(1,1,1)。則D處微粒的坐標(biāo)參數(shù)為_________。
,0);C處為(1,1,1)。則D處微粒的坐標(biāo)參數(shù)為_________。
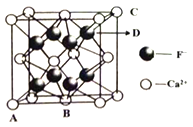
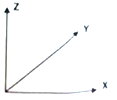
②晶胞參數(shù):描述晶胞的大小和形狀。已知CaF2晶體的密度為cg·cm-3,則晶胞中Ca2+與離它最近的F-之間的距離為_________nm(設(shè)NA為阿伏加德羅常數(shù)的值,用含C、NA的式子表示;相對(duì)原子質(zhì)量:Ca 40 F 19)。
查看答案和解析>>
科目:高中化學(xué) 來(lái)源: 題型:
【題目】一定溫度下,影響一定質(zhì)量氣體體積大小的決定因素是( )
A.氣體的密度
B.氣體分子體積的大小
C.氣體分子間的平均距離
D.氣體的相對(duì)分子質(zhì)量
查看答案和解析>>
科目:高中化學(xué) 來(lái)源: 題型:
【題目】(1)請(qǐng)用下列4種物質(zhì)的序號(hào)填空:①O2 ②NH4NO3 ③K2O2 ④NH3,既有離子鍵又有極性鍵的是___________。(填序號(hào))
(2)氯化鋁的物理性質(zhì)非常特殊,如:氯化鋁的熔點(diǎn)為190 ℃(2.02×105 Pa),但在180 ℃就開(kāi)始升華。據(jù)此判斷,氯化鋁是___________(填“共價(jià)化合物”或“離子化合物”),設(shè)計(jì)實(shí)驗(yàn)證明你的判斷正確的實(shí)驗(yàn)依據(jù)是________________。
(3)現(xiàn)有a~g7種短周期元素,它們?cè)谥芷诒碇械奈恢萌缦拢?qǐng)據(jù)此回答下列問(wèn)題:
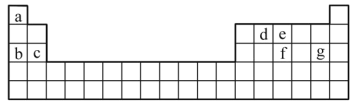
①元素的原子間反應(yīng)最容易形成離子鍵的是___________。
A.c和f B.b和g C.d和g D.b和e
②d與g元素形成的分子中所有原子___________(填“是”或“不是”)都滿足最外層為8電子結(jié)構(gòu)。
(4)A、B、C、D四種短周期元素,它們的原子序數(shù)依次增大,其中A與C,B與D分別是同主族元素,已知B、D兩元素間可形成DB2和DB3兩種化合物,兩者相對(duì)分子質(zhì)量相差16;又如A、C兩元素原子序數(shù)之和是B、D兩元素原子序數(shù)之和的1/2。請(qǐng)回答下列問(wèn)題:
①寫(xiě)出由B、C兩種元素形成的原子個(gè)數(shù)比為1:1的化合物的電子式:________,其晶體中所含化學(xué)鍵的類型有________。
②A2B與A2D的沸點(diǎn):A2B________A2D(填“高于”或“低于”),其原因是____________。
③由A、B、C、D四種元素形成的物質(zhì)X,與鹽酸反應(yīng)能夠生成具有刺激性氣味的氣體,寫(xiě)出X與鹽酸反應(yīng)的離子方程式:____________________________。
④碳元素的一種同位素可測(cè)定文物年代,這種同位素的符號(hào)是________。
查看答案和解析>>
科目:高中化學(xué) 來(lái)源: 題型:
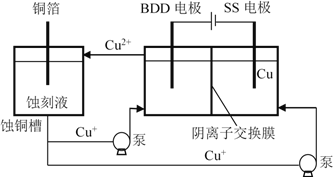
【題目】工業(yè)上用蝕刻液浸泡銅板可制備印刷電路板,產(chǎn)生的蝕刻廢液需要回收利用。
(1)應(yīng)用傳統(tǒng)蝕刻液(HCl-FeCl3)
①蝕刻銅板主要反應(yīng)的離子方程式為________。
②該蝕刻液中加入一定量鹽酸的目的為________,同時(shí)提高蝕刻速率。
③FeCl3型酸性廢液處理是利用Fe和Cl2分別作為還原劑和氧化劑,可回收銅并使蝕刻液再生。發(fā)生的主要化學(xué)反應(yīng)有:Fe+2Fe3+ ![]() 3Fe2+、Fe+Cu2+
3Fe2+、Fe+Cu2+ ![]() Fe2++Cu,還有________、________。(用離子方程式表示)。
Fe2++Cu,還有________、________。(用離子方程式表示)。
(2)應(yīng)用酸性蝕刻液(HCl-H2O2),產(chǎn)生的蝕刻廢液處理方法如下:
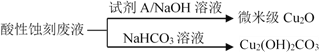
①蝕刻銅板主要反應(yīng)的離子方程式為________。
②回收微米級(jí)Cu2O過(guò)程中,加入的試劑A是______(填字母)。
a.Fe粉 b.葡萄糖 c. NaCl固體 d.酸性KMnO4溶液
③回收Cu2(OH)2CO3的過(guò)程中需控制反應(yīng)的溫度,當(dāng)溫度高于80℃時(shí),產(chǎn)品顏色發(fā)暗,其原因可能是________。
(3)應(yīng)用堿性蝕刻液(NH3H2O–NH4Cl) 蝕刻銅板,會(huì)有Cu(NH3)4Cl2和水生成。蝕刻銅板主要反應(yīng)的化學(xué)方程式為________。
(4)與常規(guī)方法不同,有研究者用HCl-CuCl2做蝕刻液。蝕銅結(jié)束,會(huì)產(chǎn)生大量含Cu+廢液,采用如圖所示方法,可達(dá)到蝕刻液再生、回收金屬銅的目的。此法采用摻硼的人造鉆石BDD電極,可直接從水中形成一種具有強(qiáng)氧化性的氫氧自由基(HO),進(jìn)一步反應(yīng)實(shí)現(xiàn)蝕刻液再生,結(jié)合化學(xué)用語(yǔ)解釋CuCl2蝕刻液再生的原理________。
查看答案和解析>>
科目:高中化學(xué) 來(lái)源: 題型:
【題目】下列說(shuō)法不正確的是
A.鈉和鉀的合金可用于快中子反應(yīng)堆作熱交換劑
B.可用超純硅制造的單晶硅來(lái)制造芯片
C.二氧化硅可用于制造玻璃
D.氯氣有毒,不能用于藥物的合成
查看答案和解析>>
科目:高中化學(xué) 來(lái)源: 題型:
【題目】紅磷P(S)和Cl2發(fā)生反應(yīng)生成PCl3和PCl5,反應(yīng)過(guò)程和能量關(guān)系如圖所示(圖中的△H表示生成1mol產(chǎn)物的數(shù)據(jù))根據(jù)上圖回答下列問(wèn)題

(1)P和Cl2反應(yīng)生成PCl3的熱化學(xué)方程式:
;
(2)PCl5分解生成PCl3和Cl2的熱化學(xué)方程式:
;
溫度T1時(shí),在密閉容器中加入0.8mol PCl5 ,反應(yīng)達(dá)到平衡時(shí)還剩余0.6mol PCl5 ,其分解率α1等于
(3)P和Cl2分兩步反應(yīng)生成1mol PCl5的△H3= ;
P和Cl2一步反應(yīng)生成1mol PCl5的△H4 △H3(填“大于”,“小于”或“等于”) 。
查看答案和解析>>
國(guó)際學(xué)校優(yōu)選 - 練習(xí)冊(cè)列表 - 試題列表
湖北省互聯(lián)網(wǎng)違法和不良信息舉報(bào)平臺(tái) | 網(wǎng)上有害信息舉報(bào)專區(qū) | 電信詐騙舉報(bào)專區(qū) | 涉歷史虛無(wú)主義有害信息舉報(bào)專區(qū) | 涉企侵權(quán)舉報(bào)專區(qū)
違法和不良信息舉報(bào)電話:027-86699610 舉報(bào)郵箱:58377363@163.com