
【題目】常溫下,向10mL0.1mol·L-1的HR溶液中逐滴滴入0.1mol·L-1的NH3·H2O溶液,所得溶液pH及導電性變化如圖。下列分析正確的是( )

A. HR為強酸
B. a、b兩點所示溶液中水的電離程度相同
C. b點溶液中c(NH![]() )>c(R-)、c(OH-)>c(H+)
)>c(R-)、c(OH-)>c(H+)
D. a~c任意點溶液均有c(H+)·c(OH-)=Kw=1.0×10-14
【答案】D
【解析】A.根據圖知,0.1mol/L的HR溶液pH>1,說明HR部分電離,則HR為弱酸,A錯誤;B.酸或堿抑制水電離,且酸中c(H+)越大、堿中c(OH-)越大,其抑制水電離程度越大,含有弱離子的鹽促進水電離,a溶液呈酸性抑制水電離,b點溶液恰好反應,生成的鹽水解,促進水的電離,B錯誤;C.b點溶液的pH=7,則溶液中存在c(H+)=c(OH-),結合電荷守恒得c(NH4+)=c(R-),該點溶液中水電離程度很小,所以離子濃度大小順序是c(NH4+)=c(R-)>c(OH-)=c(H+),C錯誤;D.離子積常數只與溫度有關,溫度不變,離子積常數不變,所以這幾點溶液中離子積常數不變,D正確;答案選D。


科目:高中化學 來源: 題型:
【題目】關于鍵長、鍵能和鍵角的說法中不正確的是
A. 鍵角是描述分子立體結構的重要參數B. 鍵長的大小與成鍵原子的半徑有關
C. 多原子分子的鍵角一定,表明共價鍵具有方向性D. 鍵能越大,鍵長就越長,共價化合物也就越穩定
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列物質:①H3O+ ②[Cu(NH3)4]2+ ③CH3COO- ④NH3 ⑤CO中存在配位鍵的是
A. ①② B. ①②③ C. ③④⑤ D. ①②⑤
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】金屬鋁分別和O2、O3發生反應生成Al2O3,反應過程和能量關系如下圖所示(圖中的ΔH表示生成1 mol產物的數據)。下列有關說法中不正確的是

A. Al(s)與O3(g)反應的熱化學方程式為2Al(s)+O3(g)![]() Al2O3(s) ΔH =-1559.5 kJ·mol-1
Al2O3(s) ΔH =-1559.5 kJ·mol-1
B. 等質量的O2比O3的能量低
C. 1 mol O2完全轉化為O3,需吸收142 kJ的熱量
D. 給3O2(g)![]() 2O3(g)的平衡體系加熱,有利于O3的生成
2O3(g)的平衡體系加熱,有利于O3的生成
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】意大利羅馬大學的Fulvio Cacace等人獲得極具理論研究意義的N4分子。N4分子結構如圖所示,已知斷裂1mol N-N吸收167kJ熱量,生成1molN≡N放出942kJ熱量.根據以上信息和數據,下列說法正確的是( )

A. N4屬于一種新型的化合物
B. N4的沸點比P4(白磷)的高
C. 理論上可以將N4轉化為N2的反應設計成原電池
D. 1mol N4所含有的能量比2mol N2所含有的能量高
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】向1 L含0.01 mol NaAlO2和0.02 mol NaOH的溶液中緩慢通入CO2,隨n(CO2)增大,先后發生三個不同的反應,當0.01 mol<n(CO2) ![]() 0.015時發生的反應是:2 NaAlO2+ CO2+3H2O=2Al(OH)3↓+Na2CO3。下列對應關系正確的是
0.015時發生的反應是:2 NaAlO2+ CO2+3H2O=2Al(OH)3↓+Na2CO3。下列對應關系正確的是
選項 | n(CO2)/mol | 溶液中離子的物質的量濃度 |
A | 0 | c(Na+)>c(AlO2-)+c(OH-) |
B | 0.01 | c(Na+)>c(AlO2-)> c(OH-)>c(CO32-) |
C | 0.015 | c(Na+)> c(HCO3-)>c(CO32-)> c(OH-) |
D | 0.03 | c(Na+)> c(HCO3-)> c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】研究電化學腐蝕及防護的裝置如圖所示。下列有關說法錯誤的是( )
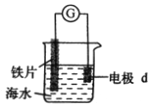
A. d為石墨,鐵片腐蝕加快
B. d為石墨,石墨上電極反應為:O2+2H2O+4e ═ 4OH-
C. d為鋅塊,鐵片不易被腐蝕
D. d為鋅塊,鐵片上電極反應為:2H++2e ═ H2↑
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】研究含氮污染物的治理是環保的一項重要工作。合理應用和處理氮的化合物,在生產生活中有重要意義。

(l)T℃時,將0.6mol NO和0.2 mol O3氣體充入到2L固定容積的恒溫密閉容器中,NO的濃度隨反應時間的變化如圖甲所示。
①T℃時,反應3NO(g)+O3(g) ![]() 3NO2(g)的平衡常數K=________.
3NO2(g)的平衡常數K=________.
②不能說明反應達到平衡狀態的是_________(填序號).
A.氣體顏色不再改變
B.氣體的平均摩爾質量不再改變
C.氣體的密度不再改變
D.單位時間內生成O3和NO2物質的量之比為1:3
(2)已知2NO2![]() N2O4,如圖乙所示,A是由導熱材料制成的密閉容器,B是一耐化學腐蝕且易于傳熱的透明氣囊,關閉K2,各將1molNO2通過K1、K3分別充入真空A、B中,反應起始時A、B的體積相同均為
N2O4,如圖乙所示,A是由導熱材料制成的密閉容器,B是一耐化學腐蝕且易于傳熱的透明氣囊,關閉K2,各將1molNO2通過K1、K3分別充入真空A、B中,反應起始時A、B的體積相同均為![]() L(忽略導管中的氣體體積).
L(忽略導管中的氣體體積).

①若容器A中到達平衡所需時間![]() s,達到平衡后容器內壓強為起始壓強的0.8倍,則平均化學反應速率
s,達到平衡后容器內壓強為起始壓強的0.8倍,則平均化學反應速率![]() _____________________.
_____________________.
②若打開K2,平衡后B容器的體積縮至0.4![]() L,則打開K2之前,氣球B體積為_________L.
L,則打開K2之前,氣球B體積為_________L.
③若平衡后在A容器中再充入0.5molN2O4,則重新到達平衡后,平衡混合氣中NO2的體積分數___________(填“變大”“變小”或“不變”)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列方案能達到實驗目的的是( )
A. 用濃硫酸干燥氨氣B. 用乙醇萃取碘水中的碘單質
C. 用品紅溶液鑒別SO2和CO2D. 用焰色反應鑒別NaCl和NaOH
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com