
(共16分)
(1)現有反應:mA(g)+nB(g)  pC(g),達到平衡后,當升高溫度時,B的轉化率變大;當減小壓強時,混合體系中C的質量分數減小,則:
pC(g),達到平衡后,當升高溫度時,B的轉化率變大;當減小壓強時,混合體系中C的質量分數減小,則:
①該反應的逆反應為______反應(填“吸熱”或“放熱”),且m+n______ p (填“>”、“=”或“<”)。
②減壓使容器體積增大時,A的質量分數________。(填“增大”、“減小”或“不變”,下同)
③若容積不變加入B,則A的轉化率__________,B的轉化率________。
④若升高溫度,則平衡時B、C的濃度之比  將________。
將________。
⑤若加入催化劑,平衡時氣體混合物的總物質的量________________________________
(2)在一容積為2 L的密閉容器中,加入0.2 mol的N2和0.6 mol的H2,在一定條件下發生如下反應:
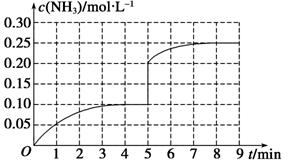
N2(g)+3H2(g) 2NH3(g) ΔH<0。反應中NH3的物質的量濃度的變化情況如圖所示,請回答下列問題:
2NH3(g) ΔH<0。反應中NH3的物質的量濃度的變化情況如圖所示,請回答下列問題:

在第5 min末將容器的體積縮小一半后,若在第8 min末達到新的平衡(此時NH3的濃度約為0.25 mol·L-1),請在圖中畫出第5 min末到平衡時NH3濃度的變化曲線。
(1)① 放熱 > ②增大 ③增大 減小 ④減小 ⑤不變
(2)如圖
【解析】(1)反應:mA(g)+nB(g)  pC(g),達到平衡后,當升高溫度時,B的轉化率變大,說明正向移動,為吸熱反應;當減小壓強時,混合體系中C的質量分數減小,則平衡左移,正反應的氣體系數減小。則:
pC(g),達到平衡后,當升高溫度時,B的轉化率變大,說明正向移動,為吸熱反應;當減小壓強時,混合體系中C的質量分數減小,則平衡左移,正反應的氣體系數減小。則:
②減壓平衡逆向移動,A的質量分數增大
③若容積不變加入B,平衡右移,則A的轉化率增大,而B的轉化率減小。
④升高溫度,則平衡正向移動, 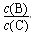 將減小。
將減小。
⑤若加入催化劑,平衡不受影響,氣體混合物的總物質的量不變
(2)_ N2(g) + 3H2(g)  2NH3(g)
2NH3(g)
初c: 0.1 0.3 0
5min時c: 0.05 0.15 0.1
此時縮小容器體積一半,各物質濃度同倍數增大一倍,相當于增壓,平衡正向移動。
_ N2(g) + 3H2(g)  2NH3(g)
2NH3(g)
5min時c: 0.1 0.3 0.2
8 min時c: 0.25


科目:高中化學 來源:2013屆江蘇省揚州中學高三開學考試化學試卷(帶解析) 題型:實驗題
(本題共16分)某研究性學習小組在研究由Fe2+制備Fe(OH)2的過程中,設計了如下實驗方案: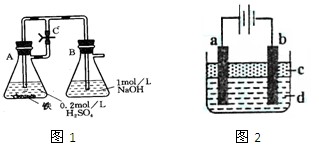
[實驗設計]
方法一:按照圖1進行實驗,容器A中的反應開始時,彈簧夾C處于打開狀態,一段時間后,關閉彈簧夾C,容器A中的反應仍在進行。最終在_______容器中觀察到白色沉淀,該實驗中涉及到的化學方程式有: 。
方法二:按圖2進行實驗,最終在兩極間的溶液中首先觀察到白色沉淀。請從所提供的試劑或電極材料中選擇正確的序號填在橫線上:
①純水 ②NaCl溶液 ③NaOH溶液 ④四氯化碳 ⑤CuCl2溶液 ⑥乙醇 ⑦Fe棒 ⑧植物油 ⑨碳棒
a為___________,b為___________,c為___________,d為___________。(填序號)
[探究思考]實驗表明上述實驗中出現白色的沉淀會逐漸轉變為灰綠色或綠色,那么如何解釋出現灰綠色或綠色的現象呢?
(1)甲同學查閱資料后,得到Fe(OH)2如下信息:
| 資料名稱 | 物理性質描述 | 化學性質描述 |
| 《化學辭典》,顧翼東編,1989年版P637 | 白色無定形粉末或白色至淡綠色六方晶體 | 與空氣接觸易被氧化,將細粉噴于空氣中,則立即燃燒出火花 |
| 《大學普通化學(下冊)》傅鷹著P637 | 白色沉淀 | 此沉淀易被氧化成微綠色Fe3(OH)8 |
| 《普通化學教程》(下冊)P788 | 白色 | 能強烈吸收O2,迅速變成棕色Fe(OH)3。這時作為氧化的中間產物為土綠色,其中含有Fe2+、Fe3+。 |
查看答案和解析>>
科目:高中化學 來源:2010年貴州省遵義四中高三上學期第二次月考(理綜)化學部分 題型:填空題
(每空2分,共16分)
A、B、C、D、E、X 都是短周期元素組成的常見無機物
根據上框圖關系,完成下列問題:
(1)A可作漂白劑,X是含有某種陽離子(此陽離子具有凈水作用)的溶液,且M(A)=M(D),
則A與H2O反應的化學方程式為 ,C轉化成D的離子方程式為
(2)A的 某種合金可作原子反應堆的導熱劑,X是非極性分子的化合物,則A與H2O反應的離子方程式為 ,C轉化成D的化學方程式為
某種合金可作原子反應堆的導熱劑,X是非極性分子的化合物,則A與H2O反應的離子方程式為 ,C轉化成D的化學方程式為
(3)A是單質,X是Na2CO3溶液,E可用消毒劑,則A與H2O反應的離子方程式為
,
(4)A是單質,X是單質(它的同素異形體是原子晶體),則E與SiO2反應的化學方程式為
(5)A是化合物,X是O2,C轉化成D還需要催化劑,E具有兩性,則A與H2O反應的化學方程式為
(6)A是化合物(Mr(A)=100),X是O2,B轉化成C還需要催化劑,E是中強堿,則A
與H2O反應的化學方程式為
查看答案和解析>>
科目:高中化學 來源:2012-2013學年云南省昆明市官渡區二中高二9月月考化學試卷(帶解析) 題型:計算題
(共16分)
(1)現有反應:mA(g)+nB(g)  pC(g),達到平衡后,當升高溫度時,B的轉化率變大;當減小壓強時,混合體系中C的質量分數減小,則:
pC(g),達到平衡后,當升高溫度時,B的轉化率變大;當減小壓強時,混合體系中C的質量分數減小,則:
①該反應的逆反應為______反應(填“吸熱”或“放熱”),且m+n______ p (填“>”、“=”或“<”)。
②減壓使容器體積增大時,A的質量分數________。(填“增大”、“減小”或“不變”,下同)
③若容積不變加入B,則A的轉化率__________,B的轉化率________。
④若升高溫度,則平衡時B、C的濃度之比 將________。
將________。
⑤若加入催化劑,平衡時氣體混合物的總物質的量________________________________
(2)在一容積為2 L的密閉容器中,加入0.2 mol的N2和0.6 mol的H2,在一定條件下發生如下反應:
N2(g)+3H2(g) 2NH3(g) ΔH<0。反應中NH3的物質的量濃度的變化情況如圖所示,請回答下列問題:
2NH3(g) ΔH<0。反應中NH3的物質的量濃度的變化情況如圖所示,請回答下列問題:
在第5 min末將容器的體積縮小一半后,若在第8 min末達到新的平衡(此時NH3的濃度約為0.25 mol·L-1),請在圖中畫出第5 min末到平衡時NH3濃度的變化曲線。
查看答案和解析>>
科目:高中化學 來源:2012-2013學年湖南省名校高三9月第一次聯考化學試卷(解析版) 題型:實驗題
(每空2分,共16分) 鋁鎂合金已成為飛機制造、化工生產等行業的重要材料。研究性學習小組的同學,為測定某含鎂3%-5%的鋁鎂合金(不含其它元素)中鎂的質量分數,設計下列兩種不同實驗方案進行探究。填寫下列空白。
 [方案一]
[方案一]
〖實驗方案〗將鋁鎂合金與足量NaOH溶液反應,測定剩余固體質量。 實驗中發生反應的化學方程式是
。
實驗中發生反應的化學方程式是
。
〖實驗步驟〗
 (1)稱取5.4g鋁鎂合金粉末樣品,溶于V mL 2.0 mol/L
NaOH溶液中。為使其反應完全,則NaOH溶液的體積V ≥ 。
(1)稱取5.4g鋁鎂合金粉末樣品,溶于V mL 2.0 mol/L
NaOH溶液中。為使其反應完全,則NaOH溶液的體積V ≥ 。
(2)過濾、洗滌、干燥、稱量固體。該步驟中若未洗滌固體,測得鎂的質量分數將 (填“偏高”、“偏低”或“無影響”)。
 [方案二
[方案二 ]
]
〖實驗方案〗將鋁鎂合金與足量稀硫酸溶液反應,測定生成氣體在通常狀況(約20℃,1.01 105Pa)的體積。
105Pa)的體積。
 〖問題討論〗(1)同學們擬選用下列實驗裝置完成實驗:
〖問題討論〗(1)同學們擬選用下列實驗裝置完成實驗:




 ①你認為最簡易的裝置其連接順序是:a接( )( )接( )( )接( )(填接口字母,可不填滿。)
①你認為最簡易的裝置其連接順序是:a接( )( )接( )( )接( )(填接口字母,可不填滿。)
②實驗開始時,先打開分液漏斗上口的玻璃塞,再輕輕打開分液漏斗可旋轉的活塞,一會兒后稀硫酸也不能順利滴入錐形瓶中。請你幫助分析原因 。
 ③實驗結束時,在讀取測量實驗中生成氫氣的體積時,你認為最合理的順序是
。
③實驗結束時,在讀取測量實驗中生成氫氣的體積時,你認為最合理的順序是
。
A.等待實驗裝置冷卻
 B.上下移動量筒f,使其中液面與廣口瓶中液面相平
B.上下移動量筒f,使其中液面與廣口瓶中液面相平
C.上下移動量筒g,使其中液面與廣口瓶中液面相平
 D.視線與凹液面的最低點水平讀取量筒中水的體積
D.視線與凹液面的最低點水平讀取量筒中水的體積
(2)仔細分析實驗裝置后,同學們經討論認為以下兩點會引起較大誤差:稀硫酸滴入錐形瓶中,即使不生成氫氣,也會將瓶內空氣排出,使所測氫氣體積偏大;實驗結束時,連接廣口瓶和量筒的導管中有少量水存在,使所測氫氣體積偏小。于是他們設計了右圖所示的實驗裝置。

 ①裝置中導管a的作用是
。
①裝置中導管a的作用是
。
②實驗前后堿式滴定管中液面讀數分別為V1 mL、V2
mL。則產生氫氣的體積為_________mL。

查看答案和解析>>
科目:高中化學 來源:2011-2012學年內蒙古巴彥淖爾市巴市一中高三上學期12月月考理綜試卷(化學部分) 題型:實驗題
(共16分)在實驗室里可用下圖所示裝置制取氯酸鉀、次氯酸鈉和探究氯水的性質。
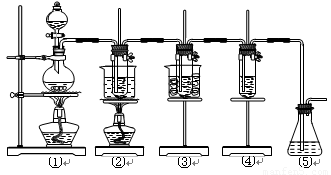
圖中:①為氯氣發生裝置;②的試管里盛有15 mL 30% KOH溶液,并置于水浴中;③的試管里盛有15 mL 8% NaOH溶液,并置于冰水浴中;④的試管里加有紫色石蕊試液;⑤為尾氣吸收裝置。
請填寫下列空白:
(1)制取氯氣時,在燒瓶里加入一定量的二氧化錳,通過_____________(填寫儀器名稱)向燒瓶中加入適量的濃鹽酸。實驗時為了除去氯氣中的氯化氫氣體,可在①與②之間安裝盛有_______(填寫下列編號字母)的凈化裝置。
(A)堿石灰 (B)飽和食鹽水 (C)濃硫酸 (D)飽和碳酸氫鈉溶液
(2)比較制取氯酸鉀和次氯酸鈉的條件,二者的差異是:____________________________。
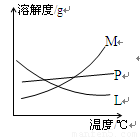
反應完畢經冷卻后,②的試管中有大量晶體析出。下圖中符合該晶體溶解度曲線的是_______(填寫編號字母);從②的試管中分離出該晶體的方法是__________(填寫實驗操作名稱)。
(3)本實驗中制取次氯酸鈉的離子方程式是______________________________________。
(4)實驗中可觀察到④的試管里溶液的顏色發生了如下變化,請填寫下表中的空白:
|
實驗現象 |
原因 |
|
溶液最初從紫色逐漸變為_______色 |
氯氣與水反應生成的H+使石蕊變色 |
|
隨后溶液逐漸變為無色 |
_______________________________ |
|
然后溶液從無色逐漸變為_______色 |
_______________________________ |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com