
A、B、C三種強電解質,它們在水中電離出的離子如下表所示:
陽離子 | Na+、K+、Cu2+ |
陰離子 | SO42-、OH- |
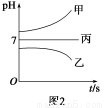
如圖1所示裝置中,甲、乙、丙三個燒杯中依次盛放足量的A溶液、足量的B溶液、足量的C溶液,電極均為石墨電極。接通電源,經過一段時間后,測得乙中c電極質量增加了16 g。常溫下各燒杯中溶液的pH與電解時間t的關系如圖2所示。請回答下列問題:
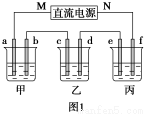
(1)M為直流電源的________極,b電極上發生的電極反應為________。
(2)計算e電極上生成的氣體在標準狀況下的體積為________________。
(3)寫出乙燒杯中的總反應的離子方程式:_________________________________。
(4)要使丙燒杯中的C溶液恢復到原來的狀態,需要進行的操作是(寫出要加入的物質和質量)______________________________。
(1)負 4OH--4e-=2H2O+O2↑
(2)5.6 L
(3)2Cu2++2H2O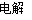 2Cu+4H++O2↑
2Cu+4H++O2↑
(4)水、4.5 g
【解析】根據題意,乙中為CuSO4溶液,c電極為陰極,M為負極,N為正極。丙為Na2SO4或K2SO4,甲為NaOH或KOH溶液,b為陽極,電極反應式為4OH--4e-=2H2O+O2↑。
(2)e電極為陰極,電極反應式為2H++2e-=H2↑,其在標準狀況下的體積為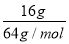 ×22.4 L·mol-1=5.6 L。
×22.4 L·mol-1=5.6 L。
(3)2Cu2++2H2O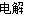 2Cu+4H++O2↑。
2Cu+4H++O2↑。
(4)電解Na2SO4或K2SO4溶液,實質是電解水,所以應向丙燒杯中加水,其質量為4.5 g。


 小學教材完全解讀系列答案
小學教材完全解讀系列答案科目:高中化學 來源:2014高考化學二輪專題突破 專題十四常見有機物及其應用練習卷(解析版) 題型:選擇題
間二甲苯的一氯代物的同分異構體有( )
A.4種 B.3種 C.2種 D.1種
查看答案和解析>>
科目:高中化學 來源:2014高考化學二輪專題突破 專題十一常見金屬元素練習卷(解析版) 題型:實驗題
某化學小組在學習元素周期律后,對教材中Fe2+氧化為Fe3+的實驗進一步思考,并提出問題:Cl2能將Fe2+氧化為Fe3+,那么Br2和I2能否將Fe2+氧化為Fe3+?
環節一:理論推測
部分同學認為Br2和I2都可能將Fe2+氧化為Fe3+,他們思考的依據是________。
部分同學認為Br2和I2都不能將Fe2+氧化為Fe3+,還有同學認為Br2能將Fe2+氧化為
Fe3+而I2不能。他們思考的依據是從上到下鹵素單質氧化性減弱。
環節二:設計實驗進行驗證
在大試管中加適量鐵粉,加入10 mL稀鹽酸,振蕩試管,充分反應后,鐵粉有剩余,取上層清液進行下列實驗:。
實驗1:
試管 | 操作 | 現象 |
① | 先向試管中加入2 mL FeCl2溶液,再滴加少量紅棕色的溴水,振蕩試管 | 溶液為黃色 |
② | 先向試管中加入2 mL FeCl2溶液,再滴加少量棕黃色的碘水,振蕩試管 | 溶液為黃色 |
環節三:實驗現象的分析與解釋
(1)同學甲認為①中現象說明溴水能將Fe2+氧化,離子方程式為________。
同學乙認為應該補充實驗,才能得出同學甲的結論。請你幫助同學乙完成實驗:
實驗2:
操作 | 應該觀察到的現象 |
(2)該小組同學對②中溶液呈黃色的原因展開了討論:
可能1:碘水與FeCl2溶液不反應,黃色是碘水稀釋后的顏色。
可能2:______________。
實驗3:進行實驗以確定可能的原因。
操作 | 現象 |
向試管②所得溶液中繼續加入0.5 mL CCl4,充分振蕩,靜置一段時間后。取出上層溶液,滴KSCN溶液 | 靜置后,上層溶液幾乎無色,下層溶液為紫色;上層溶液滴加KSCN溶液后,出現淺紅色 |
同學丙認為該實驗現象可以說明是“可能2”成立,同學丁認為不嚴謹,于是設計了實驗4:
實驗4:
操作 | 現象 |
向另一支試管中加入2 mL FeCl2溶液,滴加0.5 mL碘水后,再加入0.5 mL乙酸乙酯,充分振蕩,靜置一段時間后。取出下層溶液,滴加KSCN溶液 | 靜置后,上層溶液為紫色,下層溶液幾乎無色;下層溶液滴加KSCN溶液后,沒有出現淺紅色 |
你認為實驗4設計的主要目的是________________。
同學丁根據實驗4現象得出結論:在本次實驗條件下,碘水與FeCl2溶液反應的程度很小。
(3)Cl2、Br2、I2氧化Fe2+的能力逐漸減弱,用原子結構解釋原因:__________。
查看答案和解析>>
科目:高中化學 來源:2014高考化學二輪專題突破 專題六物質結構和元素周期律練習卷(解析版) 題型:填空題
現有七種短周期主族元素,其原子序數按A、B、C、D、E、F、G的順序遞增。A元素的最高正化合價和最低負化合價的代數和等于0,且A是形成化合物種類最多的元素;C原子能形成分別含10電子、18電子的兩種陰離子,且C與F位于同一主族;D單質投入冷水中反應緩慢,投入沸水中迅速產生氣泡;E的簡單陽離子是同周期元素所形成的簡單離子中半徑最小的。回答下列問題:
(1)B位于周期表第________周期第________族。
(2)A、B、C三種元素能形成等電子體,請寫出其中一組等電子體:________________________________________________________________________。
(3)元素M位于E與F元素之間,且M單質是優良的半導體材料,廣泛用于太陽能電池。M、F、G的氣態氫化物的穩定性由強到弱的順序為______________(用化學式表示)。
(4)若選擇三種試劑設計實驗能證明非金屬性:B>A>M,用化學方程式表示實驗原理:__________________________________________________。
(5)A、M、F、G的最高價氧化物對應水化物的酸性由強到弱的順序為________________________(用化學式表示)。
(6)下列實驗方法能證明D與E的金屬性強弱關系的是________(填字母序號)。
A.比較D和E的單質分別與稀硫酸反應產生氣泡的快慢
B.比較D和E的單質分別與同濃度的氫氧化鈉溶液反應產生氣泡的快慢
C.比較D和E的單質分別與氯氣、氧氣、硫等非金屬單質反應的產物
查看答案和解析>>
科目:高中化學 來源:2014高考化學二輪專題突破 專題六物質結構和元素周期律練習卷(解析版) 題型:選擇題
短周期元素A、B、C、D的原子序數依次遞增,它們的核電荷數之和為32,原子最外層電子數之和為10。A與C同主族,B與D同主族,A、C原子的最外層電子數之和等于B原子的次外層電子數。則下列敘述正確的是( )
A.D元素處于元素周期表中第三周期ⅥA族
B.四種元素的原子半徑:A<B<C<D
C.B、D的最高價氧化物具有相似的物理性質和化學性質
D.一定條件下,B單質能置換出D單質,C單質能置換出A單質
查看答案和解析>>
科目:高中化學 來源:2014高考化學二輪專題突破 專題八電化學練習卷(解析版) 題型:選擇題
早在1807年化學家戴維用電解熔融氫氧化鈉制得鈉:4NaOH(熔)  4Na+O2↑+2H2O;后來蓋·呂薩克用鐵與熔融氫氧化鈉作用也制得鈉:
4Na+O2↑+2H2O;后來蓋·呂薩克用鐵與熔融氫氧化鈉作用也制得鈉:
3Fe+4NaOH Fe3O4+2H2↑+4Na↑。下列有關說法正確的是( )
Fe3O4+2H2↑+4Na↑。下列有關說法正確的是( )
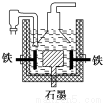
A.電解熔融氫氧化鈉制鈉,陽極發生電解反應為2OH--2e-=H2↑+O2↑
B.蓋·呂薩克法制鈉原理是利用鐵的還原性比鈉強
C.若戴維法與蓋·呂薩克法制得等量的鈉,則兩反應中轉移的電子總數不同
D.目前工業上常用電解熔融氯化鈉法制鈉(如上圖),電解槽中石墨極為陰極,鐵為陽極
查看答案和解析>>
科目:高中化學 來源:2014高考化學二輪專題突破 專題五離子反應練習卷(解析版) 題型:填空題
A、B、C、D分別是HNO3、Ba(NO3)2、NH4Cl、NaOH四種溶液中的一種。欲將它們一一鑒別,甲、乙、丙分別提出如下方案,請回答有關問題:
(1)甲同學用物質X一次性鑒別上述四種物質,他將適量的X溶液分別加入到四種溶液中,結果發現:C溶液變為棕黃色;B溶液中有白色沉淀產生;D溶液中有能使濕潤的紅色石蕊試紙變藍的氣體產生,同時產生白色沉淀,最終變為紅褐色。
B的化學式是________;D的電子式是________;X的化學式是________;A溶液中水的電離程度________(填“大于”、“小于”或“等于”)C溶液中水的電離程度。
(2)乙同學提出用明礬來鑒別上述四種物質,寫出能檢驗出NH4Cl溶液所涉及的所有離子方程式:Ba2++SO42-=BaSO4↓、________________________。
(3)丙同學用MgSO4來鑒別上述四種溶液,在生成的白色沉淀Mg(OH)2 中分別加入HNO3和NH4Cl溶液時,發現沉淀均溶解。有以下兩種解釋,同時提供下表數據:
A.NH4Cl溶液能使Mg(OH)2溶解,主要是NH4+水解產生H+的緣故。
B.NH4Cl溶液能使Mg(OH)2溶解,主要是NH4+結合OH-的緣故。
0.01 mol·L-1 電解質溶液 | HF | CH3COOH | HCN | NH3·H2O |
酸中H+或堿 中OH-的濃度/mol·L-1 | 8.00×10-4 | 1.32×10-4 | 1.00×10-4 | 1.33×10-4 |
若要證明A和B哪一種解釋正確,可以在生成的Mg(OH)2沉淀中加入一種物質,這種物質的化學式為__________________。
查看答案和解析>>
科目:高中化學 來源:2014高考化學二輪專題突破 專題二化學用語及常用計量練習卷(解析版) 題型:選擇題
在下列條件下,兩種氣體的分子數一定相等的是( )
A.同溫度、同體積的N2和O2
B.同質量、不同密度的N2和CO
C.同壓強、同體積的H2和CH4
D.同體積、同密度的CO2和N2
查看答案和解析>>
科目:高中化學 來源:2014高考化學二輪專題突破 專題七化學反應與能量練習卷(解析版) 題型:選擇題
甲醇質子交換膜燃料電池中將甲醇蒸氣轉化為氫氣的一種反應原理如下:CH3OH(g)+H2O(g)=CO2(g)+3H2(g)ΔH=+49.0 kJ·mol-1
下列說法正確的是( )
A.1 L CH3OH蒸汽與1 L水蒸氣反應生成1 L CO2氣體與3 L氫氣吸收熱量49.0 kJ
B.1個CH3OH分子與1個水分子反應生成1個CO2分子與3個H2分子吸收49.0 kJ熱量
C.相同條件下1 mol CH3OH(g)與1 mol H2O(g)的能量總和小于1 mol CO2(g)與3 mol H2(g)的能量總和
D.1 mol CH3OH蒸汽與1 mol液態水反應生成1 mol CO2氣體與3 mol氫氣吸收的熱量小于49.0 kJ
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com