
【題目】以煤、天然氣和生物質為原料制取有機化合物日益受到重視。E是兩種含有碳碳雙鍵的酯的混合物。相關物質的轉化關系如下(含有相同官能團的有機物通常具有相似的化學性質):

請回答:
(1) A→B的反應類型________,C中含氧官能團的名稱________。
(2) C與D反應得到E的化學方程式________。
(3) 檢驗B中官能團的實驗方法________。
【答案】氧化反應 羧基 ![]() +CH2=CHCOOH
+CH2=CHCOOH![]()
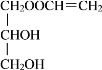 +H2O
+H2O ![]() +CH2=CHCOOH
+CH2=CHCOOH![]()
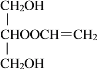 +H2O 加過量銀氨溶液,加熱,出現銀鏡,說明有醛基;用鹽酸酸化,過濾,濾液中加入溴水,若溴水褪色,說明有碳碳雙鍵
+H2O 加過量銀氨溶液,加熱,出現銀鏡,說明有醛基;用鹽酸酸化,過濾,濾液中加入溴水,若溴水褪色,說明有碳碳雙鍵
【解析】
B到C發生氧化反應,醛基被氧化成羧基,C為![]() ,油脂在酸性條件下水解得到高級脂肪酸和甘油,結合D的分子式,可知D為甘油
,油脂在酸性條件下水解得到高級脂肪酸和甘油,結合D的分子式,可知D為甘油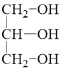 ,C和D發生酯化反應得到E,結合E的分子式可知-OH和-COOH發生1:1酯化,混合物E的結構簡式為
,C和D發生酯化反應得到E,結合E的分子式可知-OH和-COOH發生1:1酯化,混合物E的結構簡式為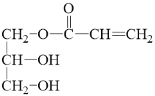 和
和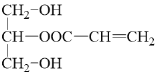 。
。
(1)根據分子組成的變化,即去氫加氧,A到B的反應類型為氧化反應,C中的含氧官能團為羧基。
(2)由上分析混合物E的結構簡式,可知C和D的酯化反應得到兩種有機產物,因而化學方程式分別為![]() +CH2=CHCOOH
+CH2=CHCOOH![]()
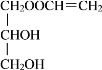 +H2O和
+H2O和![]() +CH2=CHCOOH
+CH2=CHCOOH![]()
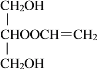 +H2O。
+H2O。
(3)B中含有碳碳雙鍵和醛基,兩者都易被氧化,其中醛基能被弱氧化劑氧化,因而需要先檢驗醛基,可采用銀氨溶液檢驗,注意這里需要加過量的銀氨溶液以便將醛基全部氧化,然后用鹽酸酸化,原因在于銀氨溶液呈堿性,能和溴水反應,然后將過濾后的濾液加入溴水,觀察現象。因而答案為加過量銀氨溶液,加熱,出現銀鏡,說明有醛基;用鹽酸酸化,過濾,濾液中加入溴水,若溴水褪色,說明有碳碳雙鍵。


科目:高中化學 來源: 題型:
【題目】大氣中CO2含量的增加會加劇溫室效應,為減少其排放,需將工業生產中產生的CO2分離出來進行儲存和利用。
(1)CO2溶于水生成碳酸,碳酸和亞硝酸(HNO2)的電離常數如下表所示,下列事實中,能說明亞硝酸酸性比碳酸強的是(填字母代號)____________。
弱酸 | HNO2 | H2CO3 |
電離常數 | Ka=5.1×10-4 | Ka1=4.6×10-7 |
Ka2=5.6×10-11 |
A 常溫下,亞硝酸電離常數比碳酸一級電離常數大
B 亞硝酸的氧化性比碳酸的氧化性強
C 亞硝酸與碳酸鈉反應生成CO2
D 相同濃度的碳酸鈉溶液的pH比亞硝酸鈉的大
(2).CO2與NH3反應可合成尿素[化學式為CO(NH2)2],反應2NH3(g)+CO2(g)CO(NH2)2(1)+H2O(g)在合成塔中進行,圖中Ⅰ,Ⅱ,Ⅲ三條曲線分別表示溫度為T℃時,按不同氨碳比![]() 和水碳比
和水碳比![]() 投料時,二氧化碳平衡轉化率的情況。
投料時,二氧化碳平衡轉化率的情況。

①曲線Ⅰ,Ⅱ,Ⅲ中水碳比的數值分別為0.6~0.7,1~1.1,1.5~1.6,則生產中應選用的水碳比數值范圍是____________。
②推測生產中氨碳比應控制在____________(選填“4.0”或“4.5”)左右比較適宜。
③若曲線Ⅱ中水碳比為1,初始時CO2的濃度為1mol/L,則T℃時該反應的平衡常數K=____________(保留有數數字至小數點后兩位)。
(3)以TiO2/Cu2Al2O4為催化劑,可以將CO2和CH4直接轉化為乙酸,請寫出該反應的化學方程式:____________。在不同溫度下催化劑的催化效率與乙酸的生成速率的關系如圖所示。在溫度為____________時,催化劑的活性最好,效率最高。請解釋圖中250~400℃時乙酸生成速率變化的原因:250~300℃時____________;300~400℃時____________。

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知:K3Fe(CN)6遇Fe2+生成藍色沉淀。固體粉末M中可能含有Cu、FeO、Fe2O3、K2SO3、Na2CO3、KCl中的若干種,為確定該固體粉末的成分,現取M進行下列實驗,實驗過程及現象如下:

下列有關說法正確的是
A. 固體中戊一定含有Fe2O3和CuO B. 氣體乙中一定含有CO2,可能含有SO2
C. 固體粉末M中一定含有KCl D. 固體粉末M中一定含有Cu、FeO,可能含有Fe2O3
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】取一定質量的NaBr、NaI的混合物平均分成四等份,分別加水配成溶液并編號甲、乙、丙、丁。再分別向各溶液中通入一定體積的氯氣。將反應后所得溶液蒸干、灼燒的固體質量列表如下:
編號 | 甲 | 乙 | 丙 | 丁 |
固體成分 | NaCl、NaBr、NaI | NaCl、NaBr、NaI | NaCl、NaBr | NaCl |
Cl2體積/mL | V | 2V | 3V | 4V |
固體質量/g | 77.3 | 59.0 | 45.4 | 40.95 |
(1)在標準狀況下,Cl2的體積V為___________mL。
(2)原混合物中NaBr的物質的量為__________mol。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有一處于平衡狀態的反應:X(s)+3Y(g)![]() 2Z (g),ΔH<0。為了使平衡向生成Z的方向移動,應選擇的條件是
2Z (g),ΔH<0。為了使平衡向生成Z的方向移動,應選擇的條件是
①高溫 ②低溫 ③高壓 ④低壓 ⑤加催化劑 ⑥分離出Z
A. ①③⑤ B. ②③⑤ C. ②③⑥ D. ②④⑥
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某同學設計如圖裝置(氣密性已檢查)制備Fe(OH)2白色沉淀。

請回答:
(1) 儀器1的名稱________。裝置5的作用________。
(2) 實驗開始時,關閉K2,打開K1,反應一段時間后,再打開K2,關閉K1,發現3中溶液不能進入4中。請為裝置作一處改進,使溶液能進入4中________。
(3) 裝置改進后,將3中反應后溶液壓入4中,在4中析出了灰綠色沉淀。從實驗操作過程分析沒有產生白色沉淀的原因________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】2SO2(g)+O2(g) ) ![]() 2SO3(g)反應過程的能量變化如圖所示,已知1 mol SO2(g)被氧化為1 mol SO3(g)的ΔH=-98 kJ/mol。回答下列問題:
2SO3(g)反應過程的能量變化如圖所示,已知1 mol SO2(g)被氧化為1 mol SO3(g)的ΔH=-98 kJ/mol。回答下列問題:

(1)圖中A、C分別表示:_____________、____________。E的大小對該反應的反應熱有無影響?_____________ 。該反應通常用V2O5作催化劑,加V2O5會使圖中B點升高還是降低?________,理由是____________________________ 。
(2)圖中ΔH=________kJ/mol。
(3)V2O5的催化循環機理可能為:V2O5氧化SO2時,自己被還原為四價釩化合物;四價釩化合物再被氧氣氧化。寫出該催化循環機理的化學方程式:___________________
(4)已知單質硫的燃燒熱為296 kJ/mol,計算由S(s)生成3 mol SO3(g)的ΔH=________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法正確的是( )
A.235g核素![]() U發生裂變反應:
U發生裂變反應:![]() U+
U+![]() n
n![]()
![]() Sr+
Sr+![]() Xe+10
Xe+10![]() n,凈產生的中子(
n,凈產生的中子(![]() n)數為10NA
n)數為10NA
B.![]() Cl與
Cl與![]() Cl得電子能力相同
Cl得電子能力相同
C.中子數為146、質子數為92的鈾(U)原子:![]() U
U
D.![]() U和
U和![]() U是中子數不同、質子數相同的同種核素
U是中子數不同、質子數相同的同種核素
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】A、B、C、D、E均為短周期的主族元素,其原子序數依次增大,A的原子電子層數等于其核外電子數,B與C可形成離子化合物CB2,D原子的M層電子數是K層電子數的3倍。
(1)A的元素符號是____。
(2)B的氫化物與E的氫化物相比,較穩定的是___(填化學式)。
(3)C、E組成的化合物的電子式是___,其中所含化學鍵的類型是___。
(4)B、D、E按原子半徑由大到小的順序排列為___(填元素符號)。
(5)C的最高價氧化物對應的水化物是___,它與D的最高價氧化物對應的水化物的稀溶液發生反應的離子方程式是____。
(6)欲證明E2的氧化性強于I2,可進行的實驗操作是___,觀察到的現象是___,有關反應的離子方程式是___。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com