熱化學方程式中的H實際上是熱力學中的一個物理量,叫做焓.一個體系的焓(H)的絕對值到目前為止還沒有辦法測得,但當體系發生變化時,我們可以測得體系的焓的變化,即焓變,用“△H”表示,△H=H(終態)-H(始態).
(1)化學反應中的△H是以 的形式體現的.
對于化學反應A+B=C+D,若H(A)+H(B)>H(C)+H(D),則該反應的△H為 0(填“大于”.“小于”),該反應是 (填“放熱”或“吸熱”)反應;
(2)進一步研究表明,化學反應的焓變與反應物和生成物的鍵能有關.
已知:H2(g)+Cl2(g)=2HCl(g)△H=-185kJ?mol-1,△H(H2)=436kJ?mol-1,
△H(Cl2)=247kJ?mol-1.則△H(HCl)= .
(3)Hess G.H在總結大量實驗事實之后認為,只要化學反應的始態和終態確定,則化學反應的△H便是定值,與反應的途徑無關.這就是有名的“Hess定律”.
已知:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-25kJ?mol-1
3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g)△H=-47kJ?mol-1
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g)△H=19kJ?mol-1
請寫出CO還原FeO的熱化學方程式: .
【答案】分析:(1)化學反應過程中一定伴隨著能量的變化,反應焓變主要是指反應前后的熱量變化;依據能量守恒分析焓變,結合焓變計算:△H=H(終態)-H(始態),H確定反應吸熱放熱;△H<0為放熱反應;△H>0為吸熱反應;
(2)化學反應的焓變與反應物和生成物的鍵能有關:△H=H(終態)-H(始態),結合題干條件計算得到;
(3)依據蓋斯定律的含義,化學反應的△H便是定值,與反應的途徑無關,結合熱化學方程式計算得到;
解答:解:(1)化學反應過程中一定伴隨著能量的變化,反應焓變主要是指反應前后的熱量變化;對于化學反應A+B=C+D,若H(A)+H(B)>H(C)+H(D):△H=H(終態)-H(始態),判斷可知△H<0;反應是放熱反應;
故答案為:熱能;小于; 放熱;
(2)已知:H2(g)+Cl2(g)=2HCl(g)△H=-185kJ?mol-1,△H(H2)=436kJ?mol-1,△H(Cl2)=247kJ?mol-1;依據△H=H(終態)-H(始態),
△H=2△H(HCl)-△H(H2)-△H(Cl2)=-185kJ?mol-1;則△H(HCl)=434 kJ?mol-1;故答案為:434 kJ?mol-1 ;
(3)依據蓋斯定律
①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-25kJ?mol-1
②3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g)△H=-47kJ?mol-1
③Fe3O4(s)+CO(g)=3FeO(s)+CO2(g)△H=19kJ?mol-1
①×3-③×2+②得到:6FeO(s)+6CO(g)═6Fe(s)+6CO2(g)△H=-66 kJ?mol-1
得到熱化學方程式為:FeO(s)+CO(g)═Fe(s)+CO2(g)△H=-11 kJ?mol-1
故答案為:FeO(s)+CO(g)═Fe(s)+CO2(g)△H=-11 kJ?mol-1
點評:本題考查了反應的能量變化,反應的焓變計算方法,焓變與物質焓的計算關系,蓋斯定律的計算應用,題目難度中等.



 寒假樂園北京教育出版社系列答案
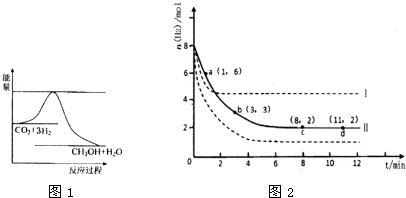
寒假樂園北京教育出版社系列答案 在化學反應中,只有極少數能量比平均能量高得多的反應物分子發生碰撞時才能發生化學反應.能引發化學反應的碰撞稱之為有效碰撞,這些分子稱為活化分子.使普通分子變成活化分子所需提供的最低限度的能量叫活化能,其單位用kJ?mol-1表示.請認真觀察下圖,然后回答問題.
在化學反應中,只有極少數能量比平均能量高得多的反應物分子發生碰撞時才能發生化學反應.能引發化學反應的碰撞稱之為有效碰撞,這些分子稱為活化分子.使普通分子變成活化分子所需提供的最低限度的能量叫活化能,其單位用kJ?mol-1表示.請認真觀察下圖,然后回答問題.
 能源是人類生存和發展的重要支柱.研究和有效地開發新能源在能源緊缺的今天具有重要的理論意義.
能源是人類生存和發展的重要支柱.研究和有效地開發新能源在能源緊缺的今天具有重要的理論意義. 在化學反應中,能引發化學反應的分子間碰撞稱之為有效碰撞,這些分子稱為活化分子.使普通分子變成活化分子所需提供的最低能量叫活化能,其單位用kJ?mol-1表示.請認真觀察圖,然后回答問題.
在化學反應中,能引發化學反應的分子間碰撞稱之為有效碰撞,這些分子稱為活化分子.使普通分子變成活化分子所需提供的最低能量叫活化能,其單位用kJ?mol-1表示.請認真觀察圖,然后回答問題.