
【題目】硼和氮的單質及一些化合物在工農業生產等領域有重要應用。回答下列問題。
(1)N原子核外有___種不同運動狀態的電子。基態N原子中,能量最高的電子所占據的原子軌道的形狀為___________。
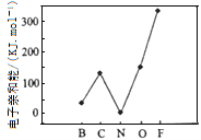
(2)元素的基態氣態原子得到一個電子形成氣態負一價離子時所放出的能量稱作第一電子親和能(E1)。第二周期部分元素的E1變化趨勢如圖所示,其中除氮元素外,其他元素的E1自左而右依次增大的原因是_______________________;氮元素的E1呈現異常的原因是_______________________。
(3)經測定發現,N2O5固體由NO2+和NO3-兩種離子組成,該固體中N原子雜化類型為___________________。
(4)銨鹽大多不穩定。NH4F、NH4I中,較易分解的是____,原因是__________________。
(5)第二周期中,第一電離能介于B元素和N元素間的元素為_____(填“元素符號”)。
(6)已知:①NO2 + CO ![]() CO2 + NO
CO2 + NO
每1mol下列物質分解為氣態基態原子消耗能量分別為
NO2 | CO | CO2 | NO |
812kJ | 1076kJ | 1490kJ | 632kJ |
②N2(g)+O2(g) ![]() 2NO(g) ΔH=+179.5 kJ/mol
2NO(g) ΔH=+179.5 kJ/mol
③2NO(g) +O2(g)![]() 2NO2(g) ΔH=-112.3 kJ/mol
2NO2(g) ΔH=-112.3 kJ/mol
試寫出NO與CO反應生成無污染物氣體的熱化學方程式_________________。
【答案】 七(或“7”) 啞鈴形(或紡錘形) 根據圖(a),同周期隨著核電荷數依次增大,原子半徑逐漸變小,故結合一個電子釋放出的能量依次增大 氮元素的2p能級達到半滿狀態,原子相對穩定,不易失去電子 sp、sp2 NH4F F原子半徑比I原子小,H→F鍵比H→I鍵強(H→F更易形成),F-更易奪取NH4+中的H+ Be、C、O ![]()
![]()
【解析】(1). N是7號元素,核外有7種不同運動狀態的電子,N原子的核外電子排布式為1s22s22p3,在基態N原子中,能量最高的電子所占據的原子軌道是2p,形狀為啞鈴形(或紡錘形),故答案為:七(或“7”);啞鈴形(或紡錘形);
(2). 根據圖(a)可知,同周期元素隨著核電荷數依次增大,原子半徑逐漸變小,吸引電子的能力逐漸增強,故結合一個電子釋放出的能量依次增大,故答案為:根據圖(a),同周期隨著核電荷數依次增大,原子半徑逐漸變小,故結合一個電子釋放出的能量依次增大;
(3). 經測定發現,N2O5固體由NO2+和NO3-兩種離子組成,NO2+的價層電子對數為:2+![]() =2,NO3-的價層電子對數為:3+
=2,NO3-的價層電子對數為:3+![]() =3,所以該固體中N原子雜化類型為sp、sp2,故答案為:sp、sp2;
=3,所以該固體中N原子雜化類型為sp、sp2,故答案為:sp、sp2;
(4). F和I屬于同一主族元素,因F原子半徑比I原子小,非金屬性F>I,所以H→F鍵比H→I鍵更強,H→F鍵比H→I鍵更易形成,F-更易奪取NH4+中的H+,所以NH4F、NH4I中,較易分解的是NH4F,故答案為:NH4F;F原子半徑比I原子小,H→F鍵比H→I鍵強(H→F更易形成),F-更易奪取NH4+中的H+;
(5). 同一周期中,隨原子序數的增大,元素的第一電離能呈增大趨勢,Be是4號元素,核外電子排布式為1s22s2,是一種全充滿的穩定結構,所以第一電離能Be>B,N原子的核外電子排布式為:1s22s22p3,是一種半充滿的穩定結構,所以第一電離能N>O,則第二周期中,第一電離能介于B元素和N元素間的元素為Be、C、O,故答案為:Be、C、O;
(6). 由表中數據可知,反應NO2(g) + CO(g)![]() CO2(g) + NO(g)的ΔH=(812+1076)kJ/mol-(1490+632)kJ/mol= -234kJ/mol,已知:①NO2(g) + CO(g)
CO2(g) + NO(g)的ΔH=(812+1076)kJ/mol-(1490+632)kJ/mol= -234kJ/mol,已知:①NO2(g) + CO(g)![]() CO2(g) + NO(g)的ΔH=-234kJ/mol、② N2(g)+O2(g)
CO2(g) + NO(g)的ΔH=-234kJ/mol、② N2(g)+O2(g) ![]() 2NO(g) ΔH=+179.5 kJ/mol、③ 2NO(g) +O2(g)
2NO(g) ΔH=+179.5 kJ/mol、③ 2NO(g) +O2(g)![]() 2NO2(g) ΔH=-112.3 kJ/mol,根據蓋斯定律可知,①×2+③-②得:2NO(g)+2CO(g)=N2(g)+2CO2(g) ΔH= -759.8kJ/mol,故答案為:2NO(g)+2CO(g)=N2(g)+2CO2(g) ΔH= -759.8kJ/mol。
2NO2(g) ΔH=-112.3 kJ/mol,根據蓋斯定律可知,①×2+③-②得:2NO(g)+2CO(g)=N2(g)+2CO2(g) ΔH= -759.8kJ/mol,故答案為:2NO(g)+2CO(g)=N2(g)+2CO2(g) ΔH= -759.8kJ/mol。


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:
【題目】將兩個鉑電極插入500mL CuSO4溶液中進行電解,通電一定時間后,某一電極增重0.064g(設電解時該電極無氫氣析出,且不考慮水解和溶液體積變化),此時溶液中氫離子濃度約為
A. 4×10-3mol/L B. 2×10-3mol/L C. 1×10-3mol/L D. 1×10-7mol/L
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一種Cu- Li可充電電池的工作原理如圖所示,其中非水系電解液和水系電解液被鋰離子固體電解質陶瓷片( LISICON)隔開。下列說法正確的是
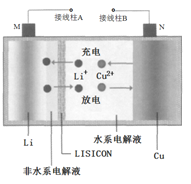
A. 陶瓷片允許水分子通過
B. 電池放電時,N極上發生氧化反應
C. 電池充電時,接線柱B應與外接直流電源的負極相連
D. 電池充電時,陰極反應為Li++e-=Li
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列敘述中正確的是
①標準狀況下,1LHCl和1LH2O的物質的量相同;
②標準狀況下,11.2 LH2和14gN2所含原子數相同;
③28gCO 的體積約為22.4 L;
④兩種物質的物質的量相同,則它們在標準狀況下的體積相同;
⑤同溫同體積時,氣體物質的物質的量越大,則壓強越大;
⑥同溫同壓下,氣體的密度與氣體的相對分子質量成正比。
A. ⑤⑥ B. ②③⑤⑥ C. ②⑤⑥ D. ①②④⑤⑥
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有硫酸鎂溶液500mL,它的密度是1.20g·cm3,其中鎂離子的質量分數是4.8%,則有關該溶液的說法不正確的是
A. 溶質的質量分數是24% B. 溶液的物質的量濃度是2.4mol·L1
C. 溶質和溶劑的物質的量之比約為1∶21.1 D. 硫酸根離子的質量是230.4g
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】CO2和H2的混和氣體加熱到1023K時,可建立下列平衡:CO2+H2![]() CO+H2O(g),在該溫度下,平衡時有90%的氫氣變成水蒸氣(平衡常數K=1),則原混合氣體中CO2和H2的分子數之比是( )
CO+H2O(g),在該溫度下,平衡時有90%的氫氣變成水蒸氣(平衡常數K=1),則原混合氣體中CO2和H2的分子數之比是( )
A. 9:1 B. 1:5 C. 1:10 D. 1:1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】請根據所學知識回答下列問題:
酸 | 電離常數 |
CH3COOH | K = 1.8×10 -5 |
H2CO3 | K1= 4.3×10 -7,K2= 5.6×10 -11 |
H2SO3 | K1=1.54×10-2 ,K2=1.02×10-7 |
(1)NaHSO3溶液中共存在7種微粒,它們是Na+、HSO3-、H+、SO32-、H2O、________、_________(填微粒符號)。
(2)常溫下,物質的量濃度相同的下列溶液 :
①NH4Cl ② NH4HCO3 ③(NH4)2SO4 ④ NH4HSO4
溶液中c(NH4+)最大的是:_________,最小的是:______(填序號)
(3)常溫下,物質的量濃度均為0.1mol/L的六種溶液①NaOH、②NaCl、③Na2CO3、④H2SO3、⑤CH3COONa、⑥H2SO4,pH從大到小排列順序為___________(填序號)
(4)常溫時,AlCl3的水溶液呈酸性,原因是(用離子方程式表示):_____________把AlCl3溶液蒸干,灼燒,最后得到的固體產物主要是________(填化學式)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下圖中,甲、乙、丙、丁分別代表相應物質與水發生的化學反應。回答下列問題:
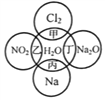
(1)甲、乙、丙、丁中,不屬于氧化還原反應的是______________(用甲乙丙丁填空,下同),屬于置換反應的是____________。
(2)寫出丁反應中產物的化學式:______________,寫出甲反應的化學方程式:________________________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com