
【題目】現有一定量的鎂鋁合金與![]() 稀硝酸充分反應,反應過程中無氣體放出。在反應結束后的溶液中,逐滴加入
稀硝酸充分反應,反應過程中無氣體放出。在反應結束后的溶液中,逐滴加入![]() NaOH溶液,加入NaOH溶液的體積與產生沉淀的物質的量的關系如圖所示。下列說法 不正確的是
NaOH溶液,加入NaOH溶液的體積與產生沉淀的物質的量的關系如圖所示。下列說法 不正確的是
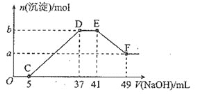
A.![]()
B.OC段反應的離子方程式為![]()
C.D點對應溶液中的溶質為![]() 和
和![]()
D.原![]() 溶液中溶質的物質的量濃度為
溶液中溶質的物質的量濃度為![]()
【答案】D
【解析】
根據題意可知,反應始終沒有氣體生成,說明沒有氮的氧化物生成,由于金屬化合價升高,推測N元素化合價只能由+5變成了-3價,由圖象可知硝酸過量,加入氫氧化鈉溶液應先與剩余的硝酸反應,之后再生成氫氧化鎂、氫氧化鋁沉淀;當沉淀完全后繼續加入NaOH溶液,沉淀量不變,說NaOH與NH4+發生反應,NH4+反應完全氫氧化鋁沉淀開始溶解,直至最后剩余氫氧化鎂沉淀,據此結合發生反應及質量守恒解答。
A、b與a的差值為氫氧化鋁的物質的量,由圖可知,EF段消耗的氫氧化鈉溶液為![]() ,故該階段參加反應的氫氧化鈉為
,故該階段參加反應的氫氧化鈉為![]() ,
,
根據![]()
![]() 可知,
可知,![]() 的物質的量為
的物質的量為![]() ,故A正確;
,故A正確;
B、OC段反應的離子方程式為:![]() ,故B正確;
,故B正確;
C、D點對應溶液為![]() 和
和![]() 的混合溶液,C項正確;
的混合溶液,C項正確;
D、DE段發生反NH4++OH-═NH3H2O,![]() ,E點對應溶液為
,E點對應溶液為![]() 和
和![]() 的混合溶液,溶液中
的混合溶液,溶液中![]() ,根據N原子守恒,原
,根據N原子守恒,原![]() 溶液中溶質的物質的量濃度為
溶液中溶質的物質的量濃度為![]() ,D項錯誤。
,D項錯誤。
答案選D。


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:
【題目】下圖是實驗室制備K2FeO4的實驗裝置圖,其中甲為制氯氣的裝置。(資料:K2FeO4為紫色固體,微溶于KOH,具有強氧化性)
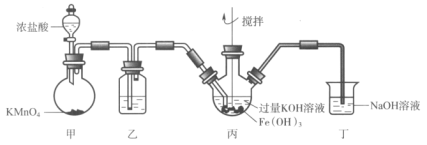
下列說法不正確的是( )
A.乙中所用試劑為飽和食鹽水
B.丙和丁中均會發生反應:Cl2+2OH-=Cl-+ClO-+H2O
C.丙中產生紫色固體,說明堿性條件下,Cl2氧化性強于K2FeO4
D.若取反應后丙中紫色溶液,加入稀硫酸產生Cl2,則證明了K2FeO4具有氧化性
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】研究碳、氮、硫等元素化合物的性質或轉化對建設生態文明、美麗中國具有重要意義.
(1)海水中無機碳的存在形式及分布如下圖所示:
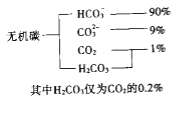
用離子方程式表示海水呈弱堿性的原因______________.已知春季海水pH=8.1,預測夏季海水堿性將會_____________(填寫“增強”或“減弱”),理由是_________________________.
(2)工業上以CO和H2為原料合成甲醇的反應:CO(g)+2H2(g)CH3OH(g) △H<0,在容積為1L的恒容容器中,分別在T1、T2、T3三種溫度下合成甲醇.如圖是上述三種溫度下不同H2和CO的起始組成比(起始時CO的物質的量均為1mol)與CO平衡轉化率的關系.下列說法正確的是_______________.
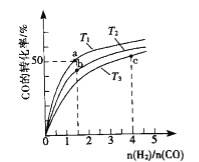
A.a、b、c三點H2轉化率:c>a>b
B.上述三種溫度之間關系為T1>T2>T3
C.a點狀態下再通入0.5 mol co和0.5 mol CH3OH,平衡不移動
D.c點狀態下再通入1 mol co和4mol H2,新平衡中H2的體積分數增大
(3)NO加速臭氧層被破壞,其反應過程如圖所示:
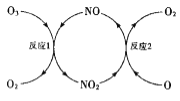
①NO的作用是___________________。
②已知:O3(g)+0(g)=202(g) △H=-143kJ·mol-l
反應1: O3(g)+NO(g)NO2(g)+O2(g) △H1=-200.2kJ·mol-l
反應2:熱化學方程式為_____________________。
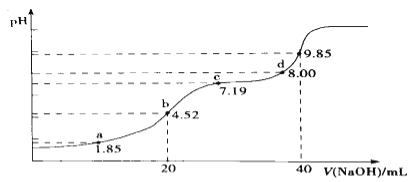
(4)大氣污染物SO2可用NaOH吸收.已知pKa=-lgKa,25℃時,H2SO3的pKa1=1.85,pKa2=7.19。該溫度下用0.1mol· L-1 NaOH溶液滴定20mL0.1mol·L-1H2SO3溶液的滴定曲線如圖所示.b點所得溶液中各離子濃度由大到小的順序是________________;c點所得溶液中:c(Na+)___________3c(HSO3-)(填“>”、“<”或“=”).
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】![]() 銅鎂合金完全溶解于
銅鎂合金完全溶解于![]() 、密度為
、密度為![]() 、質量分數為
、質量分數為![]() 的濃硝酸中,得到
的濃硝酸中,得到![]() 氣體
氣體![]() 標準狀況
標準狀況![]() ,向反應后的溶液中加入適量的
,向反應后的溶液中加入適量的![]() 溶液,恰使溶液中的金屬離子全部沉淀,下列說法不正確的是
溶液,恰使溶液中的金屬離子全部沉淀,下列說法不正確的是![]()
![]()
A.該濃硝酸中HNO3的物質的量濃度是14 mol/L
B.加入NaOH溶液的體積是160 mL
C.起氧化性的硝酸的物質的量為0.16 mol
D.得到的金屬氫氧化物的沉淀為6.24 g
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列圖示實驗合理的是
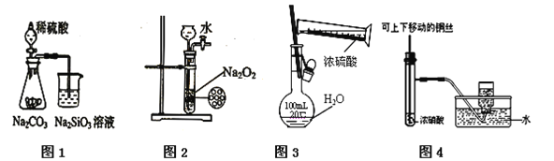
A. 圖1為證明非金屬性強弱:S > C > Si
B. 圖2為制備少量氧氣
C. 圖3為配制一定物質的量濃度的硫酸溶液
D. 圖4為制備并收集少量NO2氣體
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】消除含氮化合物對大氣和水體的污染是環境保護的重要研究課題。
(1) 化學上采用NH3處理NxOy不僅可以消除污染,還可作為工業生產的能量來源。
已知:2NO(g)=N2(g)+O2(g) △H=-177kJ/mol
4NH3(g)+3O2(g)===2N2(g)+6H2O(g) △H=-1253.4kJ/mol
則用NH3處理NO生成氮氣和氣態水的熱化學方程式為___________________。
(2)已知:N2(g)+3H2(g) ![]() 2NH3(g) △H<0。不同溫度下,向三個容器中分別投入相同量的反應物進行反應,測得不同壓強下平衡混合物中NH3的物質的量分數如圖所示。
2NH3(g) △H<0。不同溫度下,向三個容器中分別投入相同量的反應物進行反應,測得不同壓強下平衡混合物中NH3的物質的量分數如圖所示。

①M點的v正_________Q點的v正(填“>”“<”或“=”)。
②T3溫度下,將1molN2和3molH2充入2L的密閉容器中,維持壓強為60MPa不變,達到N點的平衡狀態,反應的濃度平衡常數K=_____________ (用最簡分數表示),M點的平衡常數比N點的平衡常數_________(填“大”“小”或“相等”)。
(3)水體中過量氨氮(以NH3表示)會導致水體富營養化。
①用次氯酸鈉除去氨氮的原理如圖所示。寫出總反應化學方程式:_____________。


②取一定量的含氨氮廢水,改變加入次氯酸鈉的用量,反應一段時間后,溶液中氨氮去除率、總氮(溶液中所有可溶性的含氮化合物中氮元素的總量)去除率以及剩余次氯酸鈉的含量隨m(NaClO)∶m(NH3)的變化情況如上圖所示。點B剩余NaClO含量低于點A的原因是____。當m(NaClO)∶m(NH3)>7.6時,水體中總氮去除率反而下降,可能的原因是__________。
(4)電極生物膜電解脫硝是電化學和微生物工藝的組合。某微生物膜能利用電解產生的活性原子將NO3-還原為N2,工作原理如題圖所示。若陽極生成標準狀況下2.24 L氣體,理論上可除去NO3-的物質的量為_____mol。

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】表中a、b、c表示相應儀器中加入的試劑,可用如圖所示裝置制取、凈化、收集的氣體是( )
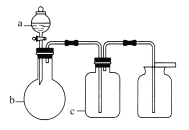
選項 | 氣體 | a | b | c |
A | NH3 | 濃氨水 | 生石灰 | 堿石灰 |
B | SO2 | 70%的濃H2SO4 | Na2SO3固體 | 98%的濃H2SO4 |
C | NO | 稀HNO3 | 銅屑 | H2O |
D | NO2 | 濃HNO3 | 銅屑 | NaOH溶液 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖所示裝置中,X是鐵,Y是石墨電極,a是硫酸鈉溶液,實驗開始前,在U形管的兩邊同時各滴入幾滴酚酞溶液,下列敘述正確的是( )
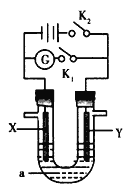
A. 閉合K1,斷開K2,X極放出H2
B. 閉合K1,斷開K2,Y極為陽極
C. 閉合K2,斷開K1,Y極的電極反應式為O2+2H2O+4e-=4OH-
D. 閉合K2,斷開K1,工作一段時間后,X電極附近溶液顯紅色
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】二甲醚(DME)被譽為“21世紀的清潔燃料”。由合成氣制備二甲醚的主要原理如下:
① CO(g)+2H2(g)![]() CH3OH(g) △H 1=-90.7 kJ·mol-1 K1
CH3OH(g) △H 1=-90.7 kJ·mol-1 K1
② 2CH3OH(g)![]() CH3OCH3(g)+H2O(g) △H 2=-23.5 kJ·mol-1 K2
CH3OCH3(g)+H2O(g) △H 2=-23.5 kJ·mol-1 K2
③ CO(g)+H2O(g)![]() CO2(g)+H2(g) △H 3=-41.2kJ·mol-1 K3
CO2(g)+H2(g) △H 3=-41.2kJ·mol-1 K3
回答下列問題:
(1)則反應3H2(g)+3CO(g)![]() CH3OCH3(g)+CO2(g)的△H=______kJ·mol-1,該反應的平衡常數K=________(用K1、K2、K3表示)
CH3OCH3(g)+CO2(g)的△H=______kJ·mol-1,該反應的平衡常數K=________(用K1、K2、K3表示)
(2)下列措施中,能提高(1)中CH3OCH3產率的有__________。
A.使用過量的CO B.升高溫度 C.增大壓強
(3)一定溫度下,0.2molCO和0.1molH2O通入2L恒容密閉容器中,發生反應③,5分鐘時達到化學平衡,平衡后測得H2的體積分數為0.1。則5分鐘v(H2O)=_______________,CO的轉化率α(CO)=___________。
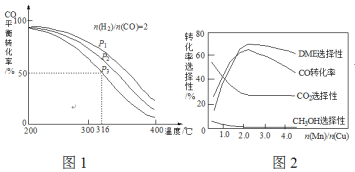
(4)將合成氣以![]() =2通入1 L的反應器中,一定條件下發生反應:4H2(g)+2CO(g)
=2通入1 L的反應器中,一定條件下發生反應:4H2(g)+2CO(g)![]() CH3OCH3(g)+H2O(g) △H,其CO的平衡轉化率隨溫度、壓強變化關系如圖1所示,下列說法正確的是___________。
CH3OCH3(g)+H2O(g) △H,其CO的平衡轉化率隨溫度、壓強變化關系如圖1所示,下列說法正確的是___________。
A.△H <0 B.P1>P2>P3
C.若在P3和316℃時,起始時![]() =3,則平衡時,α(CO)小于50%
=3,則平衡時,α(CO)小于50%
(5)采用一種新型的催化劑(主要成分是Cu-Mn的合金),利用CO和H2制備二甲醚(DME)。觀察圖2回答問題。催化劑中![]() 約為___________時最有利于二甲醚的合成。
約為___________時最有利于二甲醚的合成。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com