解:(1)①由氮化鎂中氮元素的化合價為-3價,鎂元素的化合價為+2價,則
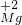
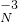
,化合價相互交叉可得化學式為Mg
3N
2,故答案為:Mg
3N
2;
②由鎂在空氣中燃燒還發生鎂與二氧化碳反應生成碳單質和氧化鎂,則反應為CO
2+2Mg

2MgO+C,故答案為:CO
2+2Mg

2MgO+C;
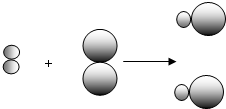
(2)①由不同的小球代表A元素的原子和B元素的原子,則反應物A
2、B
2都是由一種元素組成,而生成物由兩種元素組成,則A
2、B
2都屬于單質,故答案為:A
2、B
2;
②因同種元素具有相同的質子數,則同種元素的不同原子的質子數相同,故答案為:質子數(核電荷數);
③根據質量守恒定律可知,反應前后元素的種類、原子的種類和個數不變,參加反應的物質的質量之和等于
反應后生成物的質量之和,則a、b、d一定不變,在該反應A
2+B
2═2AB中,反應前后的分子數相等,反應前兩種
分子,而反應后一種分子,則分子的種類變化,故c不選,故答案為:a、b、d;
(3)由反應前后的質量可知,B的質量不變,B可能為催化劑,而C的質量減少22g-14g=8g,D的質量增加24g-1g=23g,根據質量守恒可知,A應質量減少,其減少的質量為23g-8g=15g,即15g的A與8gB反應生成23gD,
則設A與C的化學計量系數分別為x、y,D的化學計量數為z,
即xA+yC

zD,A與C的相對分子質量之比為15:16,
則15x:16y=15g:8g,
解得x:y=2:1,
故答案為:2:1.
分析:(1)①根據元素的化合價來書寫物質的化學式;
②根據反應物與生成物來書寫化學反應方程式;
(2)①根據單質是由一種元素組成,則由一種原子構成的分子,其對應的物質屬于單質;
②根據質子數決定元素的種類來分析同種元素;
③根據質量守恒定律來分析反應前后的變化;
(3)根據質量變化來分析反應物與生成物,再利用化學反應中參加反應的質量之比等于方程式中的相對分子質量之比(化學計量數與分子的相對分子質量的積)來解答.
點評:本題考查知識點較多,注重對化學用語的考查,學生熟悉元素的化合價、質量守恒定律、物質的分類等式解答本題的關鍵.

 表示A元素的原子,
表示A元素的原子, 表示B元素的原子.某反應前后的物質微觀示意圖如下.
表示B元素的原子.某反應前后的物質微觀示意圖如下.
 和
和 中的
中的 屬于同種元素,這是因為這些原子含有相同的______.
屬于同種元素,這是因為這些原子含有相同的______.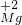
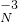 ,化合價相互交叉可得化學式為Mg3N2,故答案為:Mg3N2;
,化合價相互交叉可得化學式為Mg3N2,故答案為:Mg3N2; 2MgO+C,故答案為:CO2+2Mg
2MgO+C,故答案為:CO2+2Mg 2MgO+C;
2MgO+C; zD,A與C的相對分子質量之比為15:16,
zD,A與C的相對分子質量之比為15:16,

 新題型全程檢測期末沖刺100分系列答案
新題型全程檢測期末沖刺100分系列答案 --氫原子
--氫原子 --碳原子
--碳原子 --氧原子
--氧原子




 ”、“
”、“ ”、“
”、“ ”分別表示A、B、C三種物質的分子,下圖表示某化學反應前后反應物與生成物分子及其數目的變化.該化學方程式中A、B、C前的化學計量數之比為
”分別表示A、B、C三種物質的分子,下圖表示某化學反應前后反應物與生成物分子及其數目的變化.該化學方程式中A、B、C前的化學計量數之比為

 表示A元素的原子,
表示A元素的原子, 表示B元素的原子.某反應前后的物質微觀示意圖如下.
表示B元素的原子.某反應前后的物質微觀示意圖如下.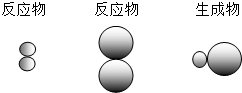
 和
和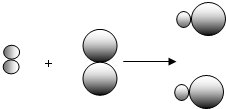 中的
中的 屬于同種元素,這是因為這些原子含有相同的
屬于同種元素,這是因為這些原子含有相同的 表示甲元素的原子,
表示甲元素的原子, 表示乙元素的原子.某反應前后的物質微觀示意圖如下.
表示乙元素的原子.某反應前后的物質微觀示意圖如下.


 和
和 中的
中的 屬于同種元素,這是因為這些原子含有相同的
屬于同種元素,這是因為這些原子含有相同的




