解:(1)由金屬活動性順序可知,題目中鐵、金Au、銀、鉛Pb的活動性為:Fe>Pb>(H)>Ag>Au;故從鐵、金Au、銀、鉛Pb混合金屬中回收某些金屬,將混合金屬放入足量的鹽酸中充分反應,然后過濾,剩余的固體中可能回收得到的金屬組合是Ag、Au;
(2)He-3的核外有2個電子,相對原子質量為3,原子結構示意圖為
,不屬于金屬元素;
(3)液態肼(用A表示)和過氧化氫(H
2O
2),混合時的反應方程式為:2H
2O
2+A═N
2+4H
2O,根據質量守恒定律的元素守恒、原子個數不變,則肼(A)的化學式為N
2H
4;
(4)因為月球上無氧氣,所以從鐵生銹條件來分析,月球上鐵制品不易生銹;
(5)①由題意“利用CO來還原TiO
2、Fe
2O
3的混合物提煉單質鈦和鐵”,可知反應物、生成物、反應條件,故化學方程式分別為:4CO+Fe
3O
4
3Fe+4CO
2或2CO+TiO
2
Ti+2CO
2;
②用CO還原鈦鐵礦,生成鈦和鐵的混合物,主用簡單的物理方法將兩種物質分開:用磁鐵吸引鐵粉;
③此題主要考慮:一氧化碳的毒性,對環境的污染性;一氧化碳的可燃性,如果不純,點燃可能會爆炸.故小亮認為這樣做不好,他的理由CO有劇毒,對空氣有污染;小亮認為先點燃C和A中的酒精燈,然后再通CO,小月又提出反對,她的理由是CO與容器內空氣混合,點燃后可能會發生爆炸;正確的方法是:先通一段時間氮氣,排盡玻璃管內空氣,然后再點燃酒精燈.
(6)①比較鈦與鐵的金屬活動性哪一種強,可以假設鈦比鐵強,根據排在前面的金屬能把后面的金屬從其鹽溶液中置換出來設計實驗,并推測反應現象;
②鈦是比較活潑的金屬,耐腐蝕性卻很強的原因可能是鈦的表面易形成致密的氧化物保護膜.
③可以使用兩者相互刻畫,出現痕跡的硬度小一些.
“物質的性質在一定程度上決定著它的用途”,鈦具有“親生物”性,在人體內能抵抗分泌物的腐蝕且無毒,可以制人造骨; 密度小,硬度大,可以用于飛機、飛船等航空工具.
(7)設需要含Fe
2O
376%的上述含氧鈦鐵礦的質量是x
4CO+Fe
3O
4
3Fe+4CO
2
232 168
x×76% 2000t×(1-3%)
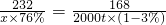
x=3525.1t
故答案為:(1)C;(2)D;(3)D;(4)不易; 月球上既沒有水又沒有空氣;
(5)①4CO+Fe
3O
4
3Fe+4CO
2;②用磁鐵吸引鐵粉;③CO有劇毒,對空氣有污染;CO與容器內空氣混合,點燃后可能會發生爆炸;先通一段時間氮氣,排盡玻璃管內空氣,然后再點燃酒精燈.
(6)①鈦的金屬活動性比鐵強;將鈦放入硫酸亞鐵溶液中;鈦的表面有黑色物質生成;②鈦的表面易形成致密的氧化物保護膜;③可以使用兩者相互刻畫,出現痕跡的硬度小一些;制人造骨;飛機、飛船等航空工具;
(7)需要含Fe
2O
376%的上述含氧鈦鐵礦的質量是3525.1t;
分析:(1)由金屬活動性順序可知:K、Ca、Na、Mg、Al、Zn、Fe、Sn、Pb、(H)、Cu、Hg、Ag、Pt、Au,則可得知:Fe>Pb>(H)>Ag>Au;故可知不與稀鹽酸反應的金屬.
(2)He-3的核外有2個電子,相對原子質量為3,原子結構示意圖為,不屬于金屬元素;
(3)根據質量守恒定律的元素守恒、原子個數不變,可知肼(A)的化學式;
(4)從鐵生銹條件來分析;
(5)①利用“類比、遷移”的方法:一氧化碳與TiO
2、Fe
2O
3分別反應,生成單質鈦和鐵;
②用CO還原鈦鐵礦,生成鈦和鐵的混合物,用簡單的物理方法將兩種物質分開:考慮磁鐵吸鐵性質;
③此題主要考慮:一氧化碳的毒性,對環境的污染性;一氧化碳的可燃性,如果不純,點燃可能會爆炸.
(6)①比較兩種金屬的活動性,可以假設一種比另一種活動性強;
②結合鋁的特點考慮;
③根據提供的信息,可以比較鈦和鋁的活動性,然后根據性質推斷用途.
(7)依據不純物質的化學方程式有關計算分析解答;
點評:此題是一道多點知識考查題,解題的關鍵是掌握有關金屬的活動性順序的應用以及金屬冶煉的有關知識;


 D.原子結構示意圖為
D.原子結構示意圖為
 ,不屬于金屬元素;
,不屬于金屬元素; 3Fe+4CO2或2CO+TiO2
3Fe+4CO2或2CO+TiO2 Ti+2CO2;
Ti+2CO2; 3Fe+4CO2
3Fe+4CO2
 3Fe+4CO2;②用磁鐵吸引鐵粉;③CO有劇毒,對空氣有污染;CO與容器內空氣混合,點燃后可能會發生爆炸;先通一段時間氮氣,排盡玻璃管內空氣,然后再點燃酒精燈.
3Fe+4CO2;②用磁鐵吸引鐵粉;③CO有劇毒,對空氣有污染;CO與容器內空氣混合,點燃后可能會發生爆炸;先通一段時間氮氣,排盡玻璃管內空氣,然后再點燃酒精燈.

 作業輔導系列答案
作業輔導系列答案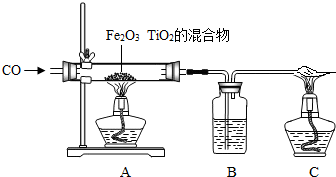
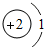 D.原子結構示意圖為
D.原子結構示意圖為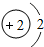
 材料:人類要在月球居住,首先離不開淡水和氧氣,而月球上既沒有水又沒有空氣.科學家發現月球的沙土中含有豐富的含氧鈦鐵礦,成分為TiO2、Fe2O3的混合物,若將這些礦石利用CO來還原可以提煉單質鈦和鐵,若用氫氣還原,可以得到淡水.若將這些礦石通電,還可以從中分離出氧氣.
材料:人類要在月球居住,首先離不開淡水和氧氣,而月球上既沒有水又沒有空氣.科學家發現月球的沙土中含有豐富的含氧鈦鐵礦,成分為TiO2、Fe2O3的混合物,若將這些礦石利用CO來還原可以提煉單質鈦和鐵,若用氫氣還原,可以得到淡水.若將這些礦石通電,還可以從中分離出氧氣. 材料:人類要在月球居住,首先離不開淡水和氧氣,而月球上既沒有水又沒有空氣.科學家發現月球的沙土中含有豐富的含氧鈦鐵礦,成分為TiO2、Fe2O3的混合物,若將這些礦石利用CO來還原可以提煉單質鈦和鐵,若用氫氣還原,可以得到淡水.若將這些礦石通電,還可以從中分離出氧氣.
材料:人類要在月球居住,首先離不開淡水和氧氣,而月球上既沒有水又沒有空氣.科學家發現月球的沙土中含有豐富的含氧鈦鐵礦,成分為TiO2、Fe2O3的混合物,若將這些礦石利用CO來還原可以提煉單質鈦和鐵,若用氫氣還原,可以得到淡水.若將這些礦石通電,還可以從中分離出氧氣.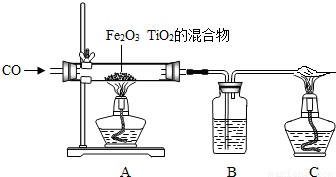
 D.原子結構示意圖為
D.原子結構示意圖為