
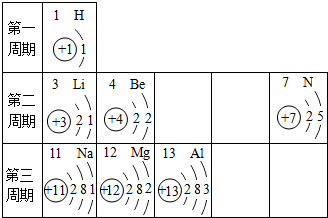
分析 (1)根據氫離子的形成來分析;
(2)根據同一周期元素原子核外電子排布的規律可從周期數與電子層數的關系、最外層電子數的變化進行分析解答.
(3)確定元素種類,然后根據化學式的寫法來分析.
解答 解:(1)氫原子的核外只有一個電子,失去后形成氫離子;故填:0;
(2)在元素周期表中,處于同一周期的元素的原子,核外電子層數相同;同一周期元素的原子,從左至右最外層電子數依次增大(合理即可).
故答案為:同一周期的元素的原子,核外電子層數相同;同一周期元素的原子,從左至右最外層電子數依次增大等.
(3)7號是氮元素,常顯-3價,12號是鎂元素,常顯+2價,二者組成的化合物是氮化鎂,其化學式為Mg3N2;故答案為:Mg3N2.
點評 本題難度不大,考查學生靈活運用元素周期表的信息、變化規律等進行分析、解題的能力.


科目:初中化學 來源: 題型:實驗探究題
| 熔點 | 沸點 | 熱穩定性 | 其他 |
| 101℃~102℃ | 150℃~160℃升華 | 100.1℃分解出水,175℃分解成CO2、CO、H2O | 與 Ca(OH)2反應產生白色沉淀(CaC2O4) |

查看答案和解析>>
科目:初中化學 來源: 題型:實驗探究題
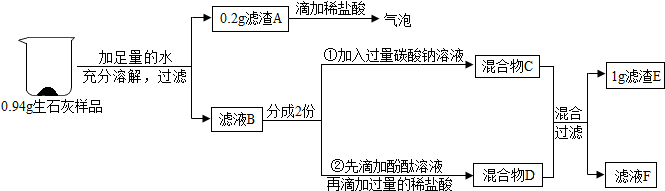
查看答案和解析>>
科目:初中化學 來源: 題型:實驗探究題
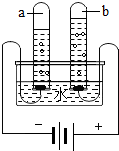 小華和小慧兩位同學分別用如圖所示的裝置進行電解水實驗.該反應的化學方程式為2H2O$\frac{\underline{\;通電\;}}{\;}$2H2↑+O2↑.為了增強水的導電性,實驗前小華向水中加入硫酸鈉固體.則b試管中產生的氣體是O2(填化學式),檢驗這種氣體的方法是帶火星的木條.
小華和小慧兩位同學分別用如圖所示的裝置進行電解水實驗.該反應的化學方程式為2H2O$\frac{\underline{\;通電\;}}{\;}$2H2↑+O2↑.為了增強水的導電性,實驗前小華向水中加入硫酸鈉固體.則b試管中產生的氣體是O2(填化學式),檢驗這種氣體的方法是帶火星的木條.| 實驗操作 | 實驗現象 | 實驗結論 |
| ①取少量剩余溶液,滴入氯化銅溶液. | 產生藍色絮狀沉淀 | 溶液中含有氫氧化鈉 |
| ②將①中反應后混合物過濾,向濾液中加入足量稀硝酸再滴入幾滴硝酸銀溶液 | 產生白色沉淀 | 溶液中含有氯化鈉 |
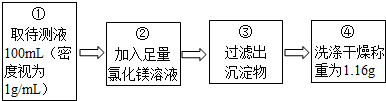
查看答案和解析>>
科目:初中化學 來源: 題型:解答題
| 小倩同學的解法 | 小明同學的解法 |
| 解:設生成的鋁質量為X 2Al2O3$\frac{\underline{\;通電\;}}{\;}$4Al+3O2↑ 204108 10t X $\frac{204}{108}$=$\frac{10t}{X}$ X=5.3t 答:最多可生產5.3t鋁 | 解:氧化鋁中鋁元素的質量分數為 $\frac{Al的相對原子質量}{A{l}_{2}{O}_{2}的相對分子質量}$×100% $\frac{27×2}{27×2+16×3}$×100%=53% 鋁的質量為10t×53%=5.3t 答:最多可生產5.3t鋁 |
查看答案和解析>>
科目:初中化學 來源: 題型:解答題
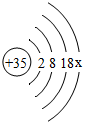 ,該元素符號為Br.圖中x=7,Br屬于非金屬元素(填金屬或非金屬).下圖表示的微粒中,具有相對穩定結構的是C(填序號,下同),與Br化學性質相似的是E.
,該元素符號為Br.圖中x=7,Br屬于非金屬元素(填金屬或非金屬).下圖表示的微粒中,具有相對穩定結構的是C(填序號,下同),與Br化學性質相似的是E.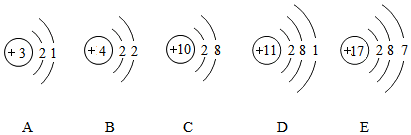
查看答案和解析>>
科目:初中化學 來源: 題型:解答題
查看答案和解析>>
科目:初中化學 來源: 題型:填空題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com