【答案】
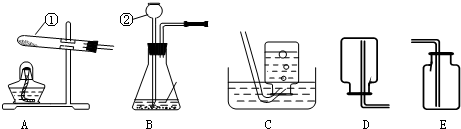
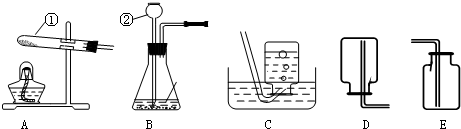
分析:(1)據常用儀器回答;
(2)據連接儀器的方法分析解答,制取氣體前要檢查裝置的氣密性,防止漏氣;
(3)根據過氧化氫溶液制取氧氣的反應物的狀態和反應條件選擇發生裝置,據氧氣的密度和溶解性選擇收集裝置,據反應原理書寫方程式,反應中二氧化錳加快了化學反應速率,起催化作用,并據二氧化錳不溶于水,故可用過濾的方法加以分離;
(4)檢驗氣體是否是氧氣,可用帶火星的木條伸入瓶內,觀察木條是否復燃進行判斷;
(5)反應過快引起爆炸,只要是能減少反應物的接觸面積,反應的速度就會降下來.
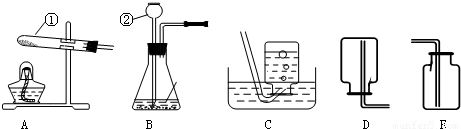
解答:解:(1)標號儀器分別是試管和長頸漏斗;
(2)連接儀器②和橡皮塞,一般采取的措施是將插入的一端玻璃管先用水潤濕一下,減小摩擦,再進行連接;組裝好實驗裝置后首先應檢查裝置氣密性,否則,如果裝置漏氣,會使實驗失敗;
(3)過氧化氫溶液和二氧化錳混合制取氧氣時,不需加熱,故選發生裝置B,氧氣的密度比空氣大且不易溶于水,所以可用向上排空氣法或排水法收集,反應方程式是:2H
2O
2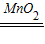
2H
2O+O
2↑;反應中二氧化錳加快了化學反應速率,起催化作用,二氧化錳不溶于水,故可用過濾的方法加以分離;
(4)檢驗氣體是否是氧氣,可用帶火星的木條伸入瓶內,觀察木條是否復燃進行判斷;
(5))降低反應速度,可以用減少反應物的接觸面積,也可以用減少催化劑的量來降低反應速度;
故答案為:(1)試管;長頸漏斗;
(2)將插入的一端玻璃管先用水潤濕一下,再進行連接;檢查裝置氣密性;
(3)B;C或E;2H
2O
2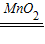
2H
2O+O
2↑;催化;過濾;
(4)將帶火星的木條伸入集氣瓶內,若復燃則是氧氣;
(5)控制過氧化氫溶液的濃度和滴加速度,合理控制催化劑的用量.
點評:本題主要考查了實驗室制取氣體發生裝置和收集裝置的選擇,發生裝置主要取決于反應物的狀態和反應條件,收集裝置主要取決于氣體的密度、溶水性,檢驗氧氣用帶火星的木條等知識,難度不大.

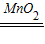 2H2O+O2↑;反應中二氧化錳加快了化學反應速率,起催化作用,二氧化錳不溶于水,故可用過濾的方法加以分離;
2H2O+O2↑;反應中二氧化錳加快了化學反應速率,起催化作用,二氧化錳不溶于水,故可用過濾的方法加以分離;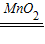 2H2O+O2↑;催化;過濾;
2H2O+O2↑;催化;過濾;

 沖刺100分單元優化練考卷系列答案
沖刺100分單元優化練考卷系列答案 根據所示實驗裝置圖,回答問題:
根據所示實驗裝置圖,回答問題: