
【題目】如圖為元素周期表的一部分。下列敘述錯誤的是

A.鈣的核電荷數是20
B.鎂在化學反應中較易失去電子
C.硫離子的結構示意圖是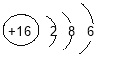
D.每個周期結尾元素的化學性質比較穩定
【答案】C
【解析】A、根據在原子中,原子序數=質子數=核外電子數=核電荷數,因此鈣的核電荷數是20;故A正確;
B、根據原子結構示意圖的特點:金屬元素的最外層電子數一般少于4,易失去最外層電子形成陽離子;因此鎂在化學反應中較易失去電子;故B正確;
C、根據原子結構示意圖的特點:非金屬元素的最外層電子數一般多于4,易得到電子,形成最外層8電子的穩定結構;而圖中核電荷數=質子數=核外電子數,為原子結構;故C錯誤;
D、根據元素周期表中每一個周期都從金屬元素開始,到稀有氣體元素結束(第一周期從非金屬元素氫開始). 稀有氣體元素,原子最外層電子數為8(氦為2 ),為穩定結構;因此每個周期結尾元素的化學性質比較穩定;故正確;
故選C.


科目:初中化學 來源: 題型:
【題目】某化學實驗小組探究堿的化學性質.
(1)A實驗的現象是_______________________;
(2)B實驗中發生的化學反應方程式為_____________________;
(3)實驗結束后將所有物質倒入同一個廢液缸中,發現底部有沉淀,上層溶液呈紅色,取上層紅色溶液加入過量的稀鹽酸,根據反應現象得到了如圖所示的實驗現象.
①加入稀鹽酸后產生的氣體是___________;
②廢液缸中上層紅色溶液中含有的溶質是_______________________.
查看答案和解析>>
科目:初中化學 來源: 題型:
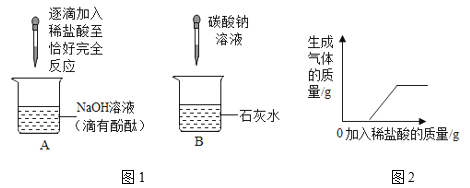
【題目】小強和其他同學在實驗室用下列裝置制取幾種氣體:
(1)寫出圖中標有番號的儀器的名稱:①______,②______。
(2)小強用鋅粒與稀硫酸制取氫氣,他選擇上述裝置中的______(填序號)進行組裝,寫出該反應的化學方程式______。
(3)小黃用熟石灰與氯化銨固體混合物加熱制取氨氣,他選擇上述裝置中的______(填序號)作發生裝置。
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】人類的日常生活和工農業生產離不開水。請回答:
(1)含有較多可溶性鈣、鎂化合物的水叫做______________(填“軟水”或“硬水”)。
(2)軟化生活用水常用的方法是__________________。
(3)下列凈化水的單一操作中,相對凈化程度較高的是_____________(填字母)
A.靜置沉淀 B.吸附沉淀 C.蒸餾
(4)水通電可以分解,其反應的化學方程式_______________。
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】鋁、鐵、銅是人類廣泛使用的三種金屬,與我們生活息息相關。
(1) 高鐵列車電路中的導線大多是銅制的,這是利用了銅的______________性。
(2) 不宜用鋼刷擦洗鋁制品的原因是______________。
(3) 只用下列一種試劑就能驗證這三種金屬的活動性順序的是______(填序號)。
A 硫酸鋁溶液 B 硫酸亞鐵溶液 C 硫酸銅溶液
(4) 小明同學用下圖裝置探究鐵生銹的條件。
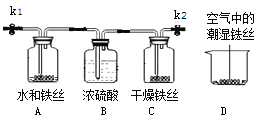
①打開K1、K2,從K1通入氧氣一段時間,然后關閉K1、K2,2天后觀察到:A處鐵絲表面布滿鐵銹,C處鐵絲依然光亮,D中鐵絲表面有部分鐵銹。
B裝置中濃硫酸的作用是_________________;
A、C處實驗現象對比說明:鐵生銹的條件之一是______________;
A、D處實驗現象對比說明:________________會影響鐵生銹快慢。
②用鹽酸除去鐵絲表面鐵銹的化學方程式為_________。
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】H7N9型禽流感是一種新型禽流感,至今尚未有疫苗推出.達菲(C16H28N2O4H3PO4)可用于H7N9的前期抗病毒治療.生產達菲的主要原料﹣﹣莽草酸(C7H10O5)可從我國盛產的八角茴香中提取.可用以下方法從八角茴香中提取莽草酸:1、將粉碎的八角茴香用有機溶劑脫脂;2、用有機溶劑浸泡脫脂物料;3、過濾;4、用活性炭脫色;5、經真空減壓蒸發濃縮后再過濾,得粗晶體.
(1)從八角茴香中提取莽草酸的過程中,用活性炭脫色是利用了活性炭的_____性;需經真空減壓蒸發濃縮而不能直接在空氣中加熱蒸發,主要是為了防止加熱時莽草酸被氧化,試寫出莽草酸在空氣中燃燒的化學方程式:_____
(2)給病人注射用的注射器由不銹鋼制的針頭和塑料制的針筒兩部分組成.其中,塑料屬于_____材料;醫院里常用高溫蒸煮的方法給醫療器械消毒,其原理是_____.
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】某化學小組利用如圖所示裝置(圖中固定裝置已略去)測定銅鋅合金中鋅的質量分數,探究過程如下:
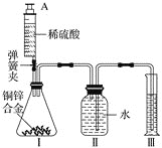
①連接實驗裝置并檢查裝置氣密性。
②向裝置Ⅰ中的錐形瓶加入2.0g的銅鋅合金樣品粉末,由注射器緩緩注入稀硫酸,待到錐形瓶中不再產生氣體時,準確讀取注射器內讀數,減少10.5mL稀硫酸,同時立即夾緊彈簧夾,移出裝置Ⅲ中的導管,準確讀取量筒內水的體積為214.0mL(注:樣品中的雜質不參加反應
③裝置Ⅰ中剩余固體物質經過適當處理后,準確稱量其質量為1.4g
④該小組的三位同學利用實驗過程測得不同數據,計算銅鋅合金樣品中鋅的質量分數
甲同學利用裝置Ⅰ中反應前后固體的質量進行計算;
乙同學利用裝置Ⅰ中加入稀硫酸的量進行計算;
丙同學利用裝置Ⅲ中量取水的體積進行計算,并查得:在標準狀況下,氫氣的密度為0.09gL-1。
回答下列問題:
(1)裝置Ⅰ中反應的化學方程式為___,實驗過程中須加入稀硫酸至不再產生氣體,目的是___。
(2)步驟③中稱量剩余固體之前的正確操作是_______、洗滌、干燥。
(3)根據實驗測定的數據,上述三位同學中________(填“甲”、“乙”或“丙”)同學無法進行計算樣品中鋅的質量分數。
(4)化學小組同學發現:按照丙同學的方案進行計算,致使實驗結果出現較大偏差。以下因素可能造成偏差的有________(填標號)。
A 移出裝置Ⅲ時,導管內留存了一部分水
B 實驗測量前,沒有排除裝置Ⅰ中的空氣
C 數據處理時,未排除加入稀硫酸所占的體積
【答案】(1)![]() ;使樣品中的鋅完全反應;(2)過濾;(3)乙;(4)AC;
;使樣品中的鋅完全反應;(2)過濾;(3)乙;(4)AC;
【解析】
試題(1)由于銅排在了氫的后面,所以與酸不反應,反應物是鋅和硫酸,生成物是硫酸鋅和氫氣,氫氣后面標上上升符號;實驗過程中須加入稀硫酸至不再產生氣體,目的是使樣品中的鋅完全反應;(2)從銅和硫酸鋅溶液的混合物中得到銅,先進行過濾,得到帶有硫酸鋅溶液的銅,再進行洗滌除去表面的硫酸鋅,再進行干燥除去水即可;(3)根據加入稀硫酸的量進行計算需要知道稀硫酸的溶質質量分數,而題中沒有告知;(4)由于鋅與硫酸反應生成硫酸鋅和氫氣時,放出熱量,如果沒等冷卻到室溫,根據熱漲冷縮的原理可知進入量筒中水偏多,所以誤認為得到的氫氣多,再就是數據處理時,未排除加入稀硫酸所占的體積,計算的結果就偏大;
考點:金屬的化學性質;化學方程式;實驗誤差分析;
點評:熟記金屬活動性順序表,知道排在氫之前的金屬和稀鹽酸或者硫酸反應生成氫氣,而排中氫之后的金屬和稀鹽酸或者稀硫酸不生成氫氣;化學反應中物質的質量比都是純凈物之間的質量比,而溶液中溶質的質量=溶液質量×溶質質量分數;本題容易出錯的地方是對實驗結果的評價,要知道鋅與硫酸反應放出熱量,會造成相應的誤差,必須冷卻到室溫才能進行觀察和計算。
【題型】實驗題
【結束】
30
【題目】用1000t含氧化鐵80%的赤鐵礦石,理論上可以煉出含鐵96%的生鐵的質量是多少?
查看答案和解析>>
科目:初中化學 來源: 題型:
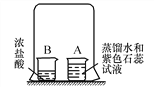
【題目】在燒杯A中裝入20 mL蒸餾水,滴入2~3滴紫色石蕊試液;在燒杯B中裝入10 mL濃鹽酸,然后用一只大燒杯把A、B兩燒杯罩在一起(如圖所示)。過幾分鐘后,可以觀察到燒杯A中液體變成________色。由該實驗可知(濃)鹽酸具有的性質是:
(1)_____________________________________________________________;
(2)____________________________________________________________。
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】根據下列實驗裝置圖,回答有關問題。
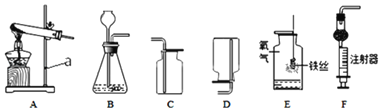
(1)儀器a的名稱是_____。
(2)實驗室用高錳酸鉀制取氧氣,選用的發生裝置是_____(填字母),該反應的方程式為_____。裝置E中,鐵絲與氧氣反應的化學方程式_____。
(3)實驗室制取二氧化碳的化學方程式為_____,選用的收集裝置是_____(填字母)。制取二氧化碳時,用裝置F替代裝置B的兩條優點是_____,_____。
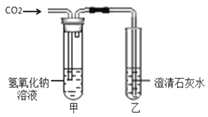
(4)為研究二氧化碳會與氫氧化鈉發生反應,采用如圖裝置進行實驗。通入二氧化碳后,看到乙中_____現象,說明二氧化碳與氫氧化鈉發生反應;若對原裝置改動繼續實驗,看到石灰水變渾濁,也能達到目的,改進的方法是_____;若將二氧化碳通入氫氧化鈉的酒精溶液,觀察到溶液由澄清變渾濁,解釋原因_____。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com