
【題目】反應Fe(s)+CO2(g)FeO(s)+CO(g),700℃時平衡常數為1.47,900℃時平衡常數為2.15.下列說法正確的是( )
A.升高溫度該反應的正反應速率增大,逆反應速率減小
B.該反應的化學平衡常數表達式為K= ![]()
C.該反應的正反應是吸熱反應
D.增大CO2濃度,平衡常數增大
【答案】C
【解析】A.升溫,正、逆反應速率均增大,A不符合題意;
B.固體濃度視為常數,不列入平衡常數的表達式,故該化學平衡常數表達式為 ![]() ,B不符合題意;
,B不符合題意;
C.升溫,平衡常數增大,表明平衡向正反應方向移動,即正反應為吸熱反應,C符合題意;
D.平衡常數只與溫度有關,與濃度無關;故增大反應物濃度,平衡常數不變,D不符合題意;
所以答案是:C
【考點精析】解答此題的關鍵在于理解化學平衡狀態本質及特征的相關知識,掌握化學平衡狀態的特征:“等”即 V正=V逆>0;“動”即是動態平衡,平衡時反應仍在進行;“定”即反應混合物中各組分百分含量不變;“變”即條件改變,平衡被打破,并在新的條件下建立新的化學平衡;與途徑無關,外界條件不變,可逆反應無論是從正反應開始,還是從逆反應開始,都可建立同一平衡狀態(等效).


科目:高中化學 來源: 題型:
【題目】醇類化合物在香料中占有重要的地位,下面所列的是一些天然的或合成的醇類香料: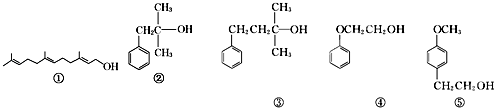
下列說法中正確的是( )
A.可用酸性KMnO4溶液檢驗①中是否含有碳碳雙鍵
B.②和③互為同系物,均能催化氧化生成醛
C.④和⑤互為同系物,可用核磁共振氫譜檢驗
D.等物質的量的上述5種有機物與足量的金屬鈉反應,消耗鈉的量相同
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】2A(g)+B(g)3C(g)+4D(g)的反應,在不同條件下的反應的速率最快的是( )
A.v(A)=0.7molL﹣1min﹣1
B.v (B)=0.3molL﹣1min﹣1
C.v (C)=0.9molL﹣1min﹣1
D.v (D)=0.8molL﹣1s﹣1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知氣態烴A的密度是相同狀況下氫氣密度的14倍,有機物A~E能發生下圖所示一系列變化,則下列說法錯誤的是
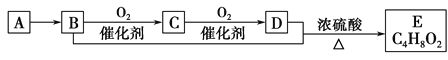
A. A分子中所有原子均在同一平面內
B. C4H8O2含酯基的同分異構體有4種
C. C的水溶液又稱福爾馬林,具有殺菌、防腐性能
D. 等物質的量的B、D與足量鈉反應生成氣體的量相等
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(實驗題)為驗證鹵素單質氧化性的相對強弱,某小組用下圖所示裝置進行實驗(夾持儀器已略去,氣密性已檢驗)
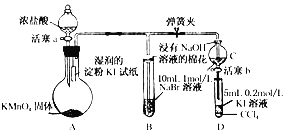
實驗過程:
Ⅰ.打開彈簧夾,打開活塞a,滴加濃鹽酸
Ⅱ.當B和C中的溶液都變為黃色時,夾緊彈簧夾
Ⅲ.當B中溶液由黃色變為棕紅色時,關閉活塞a
Ⅳ.……
(1)A中產生黃綠色氣體,其電子式是____________________
(2)驗證氯氣的氧化性強于碘的實驗現象是____________________
(3)B中溶液發生反應的離子方程式是____________________
(4)為驗證溴的氧化性強于碘,過程Ⅳ的操作和現象是__________________________________________
(5)過程Ⅲ實驗的目的是____________________
(6)氯溴碘單質的氧化性逐漸減弱的原因:同主族元素從上到下_________,得電子能力逐漸減弱
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列關于常見化學物質的應用不正確的是( )
A.干冰能用作冷凍劑
B.明礬可用作凈水劑
C.味精可用作食品調味劑
D.蘇打是一種膨松劑,可用于制作饅頭和面包
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】木炭、活性炭、炭黑、焦炭是由石墨的微小晶體和少量雜質構成的,均屬混合物。沒有固定的幾何外形,所以稱為無定形碳,在工業上有著重要用途。回答下列問題:
(1)木炭與硫黃、火硝(硝酸鉀)按一定比例混合即為黑火藥。黑火藥爆炸時生成硫化鉀、氮氣和二氧化碳。黑火藥爆炸的化學方程式為____________。若有15g木炭參加反應,轉移電子數為____________。
(2)工業上的炭黑是由烴類裂解而制得的高度分散性的黑色粉末狀物質。
①已知幾個反應的熱化學方程式:
C(s)+O2 (g)CO2(g) ΔH1=393.5 kJmol1
2H2(g)+O2 (g)2H2O(1) ΔH2=571.6 kJmol1
CH4(g)+2O2(g)CO2(g)+ 2H2O(1) ΔH3=890.3 kJmol1
則由天然氣生產炭黑的熱化學方程式為____________。
②右圖是溫度對天然氣生產炭黑轉化率的影響,下列有關說法正確的是____________。
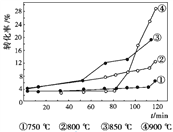
A. 甲烷裂解屬于吸熱反應
B. 增大體系壓強,能提高甲烷的轉化率
C. 在反應體系中加催化劑,反應速率增大
D. 升高溫度,該反應的平衡常數減小
(3)活性炭可以用來凈化氣體和液體。
①用活性炭還原氮氧化物,可防止空氣污染。向1 L密閉容器加入一定量的活性炭和NO,某溫度下發生反應C(s)+ 2NO(g)![]() N2(g)+CO2(g),測得不同時間內各物質的物質的量如下表:
N2(g)+CO2(g),測得不同時間內各物質的物質的量如下表:
物質的量/mol 時間/min | NO | N2 | CO2 |
0 | 0.200 | 0 | 0 |
10 | 0.116 | 0.042 | 0.042 |
20 | 0.080 | 0.060 | 0.060 |
30 | 0.080 | 0.060 | 0.060 |
此溫度下,該反應的平衡常數K=____________ (保留兩位小數)。10~20min內,NO的平均反應速率為____________;若30 min后升高溫度,達到新平衡時,容器中c(NO)∶c(N2)∶c(CO2)=2∶1∶1,則該反應的ΔH____________0(填“>”、“<”或“=”)。
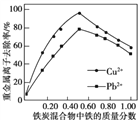
②活性炭和鐵屑混合可用于處理水中污染物。在相同條件下,測量總質量相同、鐵的質量分數不同的鐵炭混合物對水中span>Cu2+和Pb2+的去除率,結果如圖所示。當混合物中鐵的質量分數為0時,也能去除水中少量的Cu2+和Pb2+,其原因是____________;當混合物中鐵的質量分數大于50%時,隨著鐵的質量分數的增加,Cu2+和Pb2+的去除率不升反降,其主要原因是____________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某烴A蒸氣的密度是相同狀況下氫氣密度的36倍,已知該烴中的碳氫元素質量比為5:1,求:
(1)該烴的相對分子質量為______;
(2)確定該烴的分子式為______;
(3)該烴的同分異構體有______種。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在四個恒容密閉容器中按下表相應量充入氣體,發生反應2N2O(g) ![]() 2N2(g)+O2(g),容器I、II、III中N2O的平衡轉化率如下圖所示:
2N2(g)+O2(g),容器I、II、III中N2O的平衡轉化率如下圖所示:
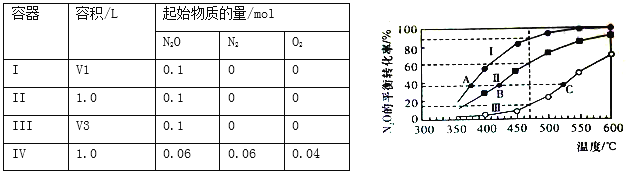
下列說法正確的是
A. 該反應的正反應放熱
B. 相同溫度下反應相同時間,平均反應速率:v(I)>v(II)
C. 容器IV在470℃進行反應時,起始速率:v正(N2O)<v逆(N2O)
D. 圖中A、B、C三點處容器內總壓強:pA(I)<pB(II)<pC(III)
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com