
CO2是生活中常見的化合物之一,隨著世界工業經濟的發展、人口的劇增,全球能源緊張及世界氣候面臨越來越嚴重的問題,人類對CO2的性質研究和綜合利用日益重視。
Ⅰ.在催化劑作用下,可由甲醇和CO2直接合成碳酸二甲酯(DMC):CO2 + 2CH3OH → CO(OCH3)2 + H2O,但甲醇轉化率通常不會超過1%,這是制約該反應走向工業化的主要原因。某研究小組在其他條件不變的情況下,通過研究溫度、反應時間、催化劑用量分別對轉化數(TON)的影響來評價催化劑的催化效果。計算公式為:TON=轉化的甲醇的物質的量/催化劑的物質的量。
(1)根據反應溫度對TON的影響圖(相同時間內測定),判斷該反應的焓變△H________0(填“>”、“=”或“<”),理由是____________________________________。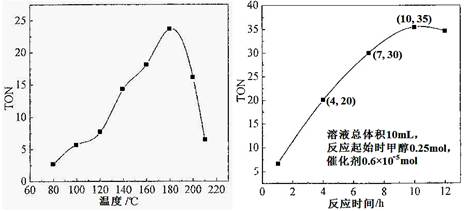
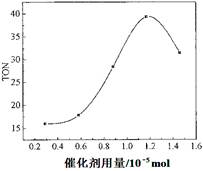
(2)根據反應時間對TON的影響圖(上圖),已知溶液總體積10mL,反應起始時甲醇0.25mol,催化劑0.6×10—5 mol,計算該溫度下,4~7 h內DMC的平均反應速率:________。
(3)根據該研究小組的實驗及催化劑用量對TON的影響圖(見上右圖),判斷下列說法正確的是 。
A.由甲醇和CO2直接合成DMC,可以利用甲醇把影響環境的溫室氣體CO2 轉化為資源,在資源循環利用和環境保護方面都具有重要意義
B. 在反應體系中添加合適的脫水劑,將提高該反應的TON
C. 當催化劑用量低于1.2×10—5 mol時,隨著催化劑用量的增加,甲醇的平衡轉化率顯著提高
D. 當催化劑用量高于1.2×10—5 mol時,隨著催化劑用量的增加DMC的產率反而急劇下降
Ⅱ.如果人體內的CO2不能順利排除體外會造成酸中毒,緩沖溶液可以抵御外來少量酸或堿對溶液pH的影響,人體血液里主要通過碳酸氫鹽緩沖體系(H2CO3/HCO3-)維持pH穩定。己知正常人體血液在正常體溫時,H2CO3的一級電離常數Ka1=10-6.1,c(HCO3-):c(H2CO3)≈20:1,lg2=0.3。
(4)由題給數據可算得正常人體血液的pH________(保留一位小數)。
(5)正常人體血液中H2CO3、HCO3-、OH-、H+四種微粒濃度由大到小關系為: 。
(6)當少量的酸、堿進入血液中時,血液pH變化不大,其原因是 。
(1)<; 經過相同的反應時間,溫度較低時,反應未達到平衡;溫度較高時,反應已達到平衡,隨著溫度升高,TON減小,即平衡向左移動,說明該反應放熱 (2)1×10-3 mol·L-1·h-1
(3)AB (4) 7.4 (5)c(HCO3-)>c(H2CO3)>c(OH-)>c(H+)
(6)當少量酸進入血液中時,HCO3-就與H+發生反應來維持血液的pH穩定,當少量堿進入血液中時,H2CO3就與OH_發生反應來維持血液的pH穩定
解析試題分析:(1)根據圖像可知,經過相同的反應時間,溫度較低時,反應未達到平衡;溫度較高時,反應已達到平衡,隨著溫度升高,TON減小,即平衡向左移動,說明該反應放熱。
(2)根據圖像可知,4~7 h內DMC變化量為30-20=10,則根據TON=轉化的甲醇的物質的量/催化劑的物質的量可知,轉化的甲醇物質的量是0.6×10—5 mol×10=6×10—5 mol,其濃度是6×10—5 mol÷0.01L=6×10—3 mol/L,生成DMC的濃度是3×10—3 mol/L,所以4~7 h內DMC的平均反應速率=3×10—3 mol/L÷3h=1×10-3 mol·L-1·h-1。
(3)A、由甲醇和CO2直接合成DMC,可以利用甲醇把影響環境的溫室氣體CO2 轉化為資源,在資源循環利用和環境保護方面都具有重要意義,A正確;B、在反應體系中添加合適的脫水劑,可以降低生成物水蒸氣的濃度,促使平衡向正反應方向進行,甲醇的轉化率增大,因此將提高該反應的TON,B正確;C、根據TON=轉化的甲醇的物質的量/催化劑的物質的量可知,TON與甲醇轉化的量以及催化劑的量均有關系,所以當催化劑用量低于1.2×10—5 mol時,隨著催化劑用量的增加,甲醇的平衡轉化率不一定烴提高,C不正確;D、催化劑不能改變平衡狀態,因此DMC的產率與催化劑無關系,D不正確,答案選AB。
(4)Ka=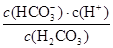 ,Ka=10-6.1mol?L-1,正常血液中c(HCO3-):c(H2CO3)≈20:1,則c(H+)=10-7.4mol?L-1,則pH=7.4。
,Ka=10-6.1mol?L-1,正常血液中c(HCO3-):c(H2CO3)≈20:1,則c(H+)=10-7.4mol?L-1,則pH=7.4。
(5)根據(4)中分析可知正常人體血液顯堿性,c(OH-)>c(H+)。已知Ka=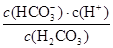 =10-6.1,血液樣品pH為7.4,則c(H+)=10-7.4mol/L,所以
=10-6.1,血液樣品pH為7.4,則c(H+)=10-7.4mol/L,所以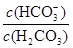 =10?6.1÷10?7.4=101.3,因此血液中H2CO3、HCO3-、OH-、H+四種微粒濃度由大到小關系為c(HCO3-)>c(H2CO3)>c(OH-)>c(H+)。
=10?6.1÷10?7.4=101.3,因此血液中H2CO3、HCO3-、OH-、H+四種微粒濃度由大到小關系為c(HCO3-)>c(H2CO3)>c(OH-)>c(H+)。
(6)血液中存在H2CO3 HCO3-+H+平衡,酸性增強時,血液中氫離子濃度增大,電離平衡逆向移動,堿性增強時氫氧根離子濃度增大,平衡正向移動,因此可以維持血液的pH穩定。
HCO3-+H+平衡,酸性增強時,血液中氫離子濃度增大,電離平衡逆向移動,堿性增強時氫氧根離子濃度增大,平衡正向移動,因此可以維持血液的pH穩定。
考點:考查外界條件對反應速率和平衡狀態的影響、可逆反應計算以及溶液中pH計算和離子濃度大小比較


 名校通行證有效作業系列答案
名校通行證有效作業系列答案科目:高中化學 來源: 題型:填空題
(6分)某學習小組利用鐵與稀硫酸的反應,進行“探究影響化學反應速率因素”的實驗。結果如下表:
| 實驗 序號 | 鐵的質量/g | 鐵的 形態 | V(H2SO4) /mL | c(H2SO4) /mol·L-1 | 反應前溶液 的溫度/℃ | 金屬完全消 失的時間/s |
| 1 | 0.10 | 片狀 | 50 | 0.8 | 20 | 200 |
| 2 | 0.10 | 粉狀 | 50 | 0.8 | 20 | 25 |
| 3 | 0.10 | 片狀 | 50 | 1.0 | 20 | 125 |
| 4 | 0.10 | 片狀 | 50 | 1.0 | 35 | 50 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
(14分)捕碳技術(主要指捕獲CO2)在降低溫室氣體排放中具有重要的作用。目前NH3和(NH4)2CO3已經被用作工業捕碳劑,它們與CO2可發生如下可逆反應:
反應Ⅰ:2NH3(l)+H2O(l)+CO2(g)  (NH4)2CO3(aq) ΔH1
(NH4)2CO3(aq) ΔH1
反應Ⅱ:NH3(l)+H2O(l)+CO2(g)  NH4HCO3(aq) ΔH2
NH4HCO3(aq) ΔH2
反應Ⅲ:(NH4)2CO3(aq)+H2O(l)+CO2(g)  2NH4HCO3(aq) ΔH3
2NH4HCO3(aq) ΔH3
請回答下列問題:
(1)ΔH3與ΔH1、ΔH2之間的關系是:ΔH3= 。
(2) 反應Ⅲ的化學平衡常數表達式為 。
(3)為研究溫度對(NH4)2CO3捕獲CO2效率的影響,在某溫度T1下,將一定量的(NH4)2CO3溶液置于密閉容器中,并充入一定量的CO2氣體(用氮氣作為稀釋劑),在t時刻,測得容器中CO2氣體的濃度。然后分別在溫度為T2、T3、T4、T5下,保持其他初始實驗條件不變,重復上述實驗,經過相同時間測得CO2氣體濃度,得到趨勢圖(見圖1)。則:
①ΔH3 0(填“>”、“=”或“<”)。
②在T1~T2及T4~T5兩個溫度區間,容器內CO2氣體濃度呈現如圖1所示的變化趨勢,其原因是
。
③反應Ⅲ在溫度為T1時,溶液pH隨時間變化的趨勢曲線如圖2所示。當時間到達t1時,將該反應體系溫度迅速上升到T2,并維持該溫度。請在該圖中畫出t1時刻后溶液的pH變化總趨勢曲線。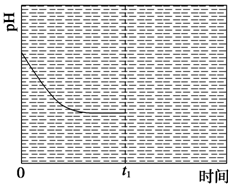
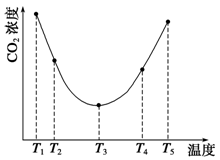
圖1 圖2
(4)利用反應Ⅲ捕獲CO2,在(NH4)2CO3初始濃度和體積確定的情況下,提高CO2吸收量的措施有
。
(5)下列物質中也可以作為CO2捕獲劑的是 。
| A.NH4Cl | B.Na2CO3 | C.HOCH2CH2OH | D.HOCH2CH2NH2 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
(17分)研究氮氧化物與懸浮在大氣中海鹽粒子的相互作用時,涉及如下反應:
2NO2(g)+NaCl(s) NaNO3(s)+ClNO(g) K1 ?H < 0 (I)
NaNO3(s)+ClNO(g) K1 ?H < 0 (I)
2NO(g)+Cl2(g)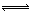 2ClNO(g) K2 ?H < 0 (II)
2ClNO(g) K2 ?H < 0 (II)
(1)4NO2(g)+2NaCl(s)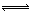 2NaNO3(s)+2NO(g)+Cl2(g)的平衡常數K= (用K1、K2表示)。
2NaNO3(s)+2NO(g)+Cl2(g)的平衡常數K= (用K1、K2表示)。
(2)為研究不同條件對反應(II)的影響,在恒溫條件下,向2L恒容密閉容器中加入0.2mol NO和0.1mol Cl2,10min時反應(II)達到平衡。測得10min內v(ClNO)=7.5×10-3mol?L-1?min-1,則平衡后n(Cl2)= mol,NO的轉化率а1= 。其它條件保持不變,反應(II)在恒壓條件下進行,平衡時NO的轉化率а2 а1(填“>”“<”或“=”),平衡常數K2 (填“增大”“減小”或“不變”。若要使K2減小,可采用的措施是 。
(3)實驗室可用NaOH溶液吸收NO2,反應為2NO2+2NaOH=NaNO3+NaNO2+H2O。含0.2mol NaOH的水溶液與0.2mol NO2恰好完全反應得1L溶液A,溶液B為0.1mol?L?1的CH3COONa溶液,則兩溶液中c(NO3?)、c(NO2-)和c(CH3COO?)由大到小的順序為 。(已知HNO2的電離常數Ka=7.1×10-4mol?L?1,CH3COOH的電離常數K a=1.7×10-5mol?L?1,可使溶液A和溶液B的pH相等的方法是 。
a.向溶液A中加適量水 b.向溶液A中加適量NaOH
c.向溶液B中加適量水 d.向溶液B中加適量NaOH
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
(17分)運用化學反應原理研究碳的化合物具有重要意義。
(1)常溫下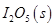 可用于檢測CO,反應原理為:
可用于檢測CO,反應原理為: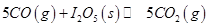
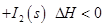 。向2L密閉容器中加入足量
。向2L密閉容器中加入足量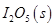 ,并通人1molCO,CO2的體積分數
,并通人1molCO,CO2的體積分數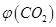 隨時間的變化如下圖所示。
隨時間的變化如下圖所示。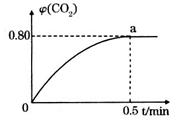
①0~0.5min內的平均反應速率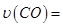 _____________。
_____________。
②保持溫度和體積不變,若開始加入CO(g)的物質的量是原來的2倍,則下列說法正確的是____________(填代號)。
a.生成I2的質量為原來的2倍
b.混合氣體的平均摩爾質量不變
c.達到平衡的時間為原來的2倍
d.混合氣體的密度不變
③反應達a點時,欲增大容器中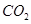 的體積分數
的體積分數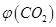 ,可采取的措施為____________。
,可采取的措施為____________。
(2)以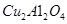 為催化劑,可以將
為催化劑,可以將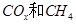 的混合氣體直接轉化為乙酸。
的混合氣體直接轉化為乙酸。
①若該反應的原子利用率為100%,則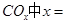 ______________。
______________。
②在25℃下,將pH=a的氫氧化鈉溶液與pH=b的醋酸溶液等體積混合,若兩溶液恰好完全反應,則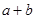 ________14(填“>”、“<”或“=”);該溫度下醋酸的電離常數K=__________(用含a、b的式子表示)。
________14(填“>”、“<”或“=”);該溫度下醋酸的電離常數K=__________(用含a、b的式子表示)。
(3)利用反應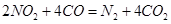 可以處理汽車尾氣,若將該反應設計為原電池,用熔融Na2O作電解質,其正極電極反應式為________________________________。
可以處理汽車尾氣,若將該反應設計為原電池,用熔融Na2O作電解質,其正極電極反應式為________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
(6分)將6molA氣體和2molB氣體在2L密閉容器中混合并在一定條件下發生反應:3A(g)+B(g) xC(g)+2D(g)。若經5min后反應達到平衡狀態,容器內的壓強變小,并知D的平均反應速率為0.2mol/(L?min),請填寫下列空白:
xC(g)+2D(g)。若經5min后反應達到平衡狀態,容器內的壓強變小,并知D的平均反應速率為0.2mol/(L?min),請填寫下列空白:
①x的數值為 ; ②A的平均反應速率為 ; ③5min時B的轉化率為 。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
(14分)
含硫化合物在工業生產中有廣泛的用途。
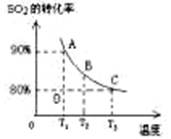
(1)對于可逆反應2SO2(g)+O2(g)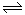 2SO3(g) △H<0,下列研究目的和圖示相符的是
2SO3(g) △H<0,下列研究目的和圖示相符的是
(填序號)
| 序號 | A | B | C | D |
| 目的 | 壓強對平衡的影響 | 溫度對轉化率的影響 | 增加O2濃度對速率的影響 | 濃度對平衡常數的影響 |
| 圖示 | 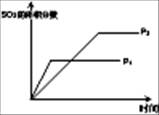 |  | 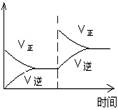 | 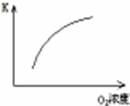 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
(15分)含鉻污水處理是污染治理的重要課題。污水中鉻元素以Cr2O72-和CrO42-形式存在,常見除鉻基本步驟是: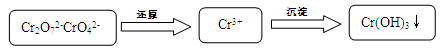
(1)加酸可以使CrO42-轉化為Cr2O72-: 2CrO42- + 2H+ Cr2O72- + H2O
Cr2O72- + H2O
若常溫下pH=1溶液中Cr2O72-濃度為0.1 mol?L-1,Cr2O72-濃度是CrO42-濃度的10倍,該化學平衡常數K= 。
(2)六價鉻的毒性大約是三價鉻的100倍,二氧化硫還原法是在酸性溶液中通SO2將Cr2O72-還原,反應的離子方程式為 。而后再加堿將Cr3+沉淀,已知常溫下Ksp[Cr(OH)3] =10-32,要使c(Cr3+)降低到10-5mol?L-1,溶液的pH應升高到 。
(3)電解還原法是利用電解產生的Fe2+將Cr2O72-還原為Cr3+.電解裝置所用的電極材料是碳棒和鐵片,其中鐵片連接直流電源的 極。
(4)Cr(OH)3為綠色粘性沉淀,類似于Al(OH)3既溶于酸又能溶于強堿溶液。Cr(OH)3溶于稀硫酸的化學方程式為 。往100.00mL 0.1000 mol?L-1CrCl3溶液滴加1.000mol?L-1NaOH溶液, 請畫出生成沉淀的物質的量與加入NaOH溶液體積的關系圖: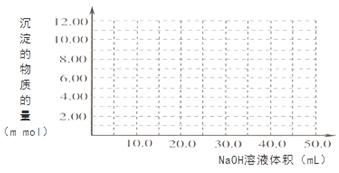
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
由于溫室效應和資源短缺等問題,如何降低大氣中的CO2含量并加以開發利用,引用了各界的普遍重視。目前工業上有一種方法是用CO2生產燃料甲醇。一定條件下發生反應:CO2(g)+3H2(g)  CH3OH(g)+H2O(g),該反應的能量變化如圖所示:
CH3OH(g)+H2O(g),該反應的能量變化如圖所示: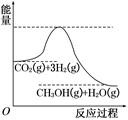
(1)上述反應平衡常數K的表達式為 ,溫度降低,平衡常數K (填“增大”、“不變”或“減小”)。
(2)在體積為2 L的密閉容器中,充入1 mol CO2和3 mol H2,測得CO2的物質的量隨時間變化如下表所示。從反應開始到5 min末,用氫氣濃度變化表示的平均反應速率v(H2)= 。
| t/min | 0 | 2 | 5 | 10 | 15 |
| n(CO2)/mol | 1 | 0.75 | 0.5 | 0.25 | 0.25 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com