
【題目】醋酸、鹽酸是生活中常見的物質。
(1)25℃時,濃度均為0.1mol·L-1的鹽酸和醋酸溶液,下列說法正確的是___。
a.兩溶液的pH相同
b.兩溶液的導電能力相同
c.兩溶液中由水電離出的c(OH-)相同
d.中和等物質的量的NaOH,消耗兩溶液的體積相同
(2)25℃時,pH均等于4的醋酸溶液和鹽酸溶液,醋酸溶液中水電離出的H+濃度與鹽酸溶液中水電離出的H+濃度之比是___。
(3)醋酸溶液中存在電離平衡:CH3COOH![]() CH3COO-+H+,下列敘述不正確的是___。
CH3COO-+H+,下列敘述不正確的是___。
a.CH3COOH溶液中離子濃度關系滿足:c(H+)=c(OH-)+c(CH3COO)
b.0.1mol·L-1的CH3COOH溶液加水稀釋,溶液中c(OHˉ)減小
c.CH3COOH溶液中加入少量CH3COONa固體,平衡逆向移動
d.常溫下,pH=2的CH3COOH溶液與pH=12的NaOH溶液等體積混合后溶液的pH>7
e.室溫下pH=3的醋酸溶液加水稀釋,溶液中![]() 不變
不變
(4)常溫下,有pH相同、體積相同的醋酸和鹽酸兩種溶液,采取以下措施:
a.加水稀釋10倍后,醋酸溶液中的c(H+)__(填“>”“=”或“<”)鹽酸溶液中的c(H+)。
b.加等濃度的NaOH溶液至恰好中和,所需NaOH溶液的體積:醋酸__(填“>”“=”或“<”)鹽酸。
c.使溫度都升高20℃,溶液中c(H+):醋酸__(填“>”“=”或“<”)鹽酸。
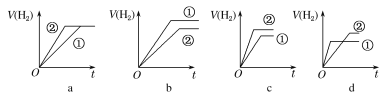
d.分別與足量的鋅粉發生反應,下列關于氫氣體積(V)隨時間(t)變化的示意圖正確的是__(填字母)。(①表示鹽酸,②表示醋酸)
(5)將0.1mol·L-1的CH3COOH加水稀釋,有關稀釋后醋酸溶液的說法中,正確的是__(填字母)。
a.電離程度增大
b.溶液中離子總數增多
c.溶液導電性增強
d.溶液中醋酸分子增多
【答案】d 1:1 bd > > > c ab
【解析】
(1)a.CH3COOH是弱電解質,HCl是強電解質,等濃度的兩種溶液中鹽酸中c(H+)大于CH3COOH,所以醋酸的pH大于HCl,故錯誤;
b.CH3COOH是弱電解質,HCl是強電解質,等濃度的兩種溶液中鹽酸中離子濃度大于醋酸,溶液的導電能力與離子濃度成正比,所以HCl溶液的導電能力強,故錯誤;
c.酸抑制水電離,酸中氫離子濃度越大,其抑制程度越大,等濃度的兩種酸中,HCl中氫離子濃度大于醋酸,所以由水電離出的c(OH-)醋酸大于鹽酸,故錯誤;
d.中和等物質的量的NaOH溶液,消耗酸的體積與酸的濃度成反比,兩種酸的物質的量濃度相等,所以需要酸的體積相等,故正確;
故選④;
(2)25℃時,pH均等于4的醋酸溶液和鹽酸溶液中由酸電離出的c(H+)相等,則對水的電離抑制程度相同,所以醋酸溶液中水電離出的H+濃度與鹽酸溶液中水電離出的H+濃度之比是1:1;
(3)a.CH3COOH溶液中,根據電荷守恒可知:c(H+)=c(OH-)+c(CH3COO),故a正確;
b.0.1mol/L的CH3COOH溶液加水稀釋,溶液酸性減弱,則溶液中c(OH-)增大,故b錯誤;
c.CH3COOH溶液中加入少量CH3COONa固體,醋酸根離子濃度增大,則平衡逆向移動,故c正確;
d.常溫下,pH=2的CH3COOH溶液濃度大于pH=12的NaOH溶液,等體積混合后,醋酸過量,則混合液呈酸性,溶液的pH<7,故d錯誤;
e.醋酸根的水解平衡常數Kh=![]() ,溫度不變水解平衡常數不變,所以室溫下pH=3的醋酸溶液加水稀釋,溶液中
,溫度不變水解平衡常數不變,所以室溫下pH=3的醋酸溶液加水稀釋,溶液中![]() 不變,故e正確;
不變,故e正確;
綜上所述選bd;
(4)a.pH相同、體積相同的醋酸和鹽酸兩種溶液分別加水稀釋后,溶液中氫離子濃度都減小,所以pH都增大,醋酸是弱酸存在電離平衡,又電離出氫離子,醋酸溶液中的c(H+)>鹽酸溶液中的c(H+);
b.pH相同的醋酸和鹽酸,醋酸的濃度大于鹽酸,加等濃度的NaOH溶液至恰好恰好中和,所需NaOH溶液的體積:醋酸>鹽酸;
c.鹽酸是強酸,不存在電離平衡,升高溫度不影響鹽酸的pH,醋酸是弱酸,其水溶液中存在電離平衡,升高溫度,促進醋酸電離,導致醋酸溶液中氫離子濃度增大,所以溶液中c(H+):醋酸>鹽酸;
d.因為強酸完全電離,一元弱酸部分電離,因此要有相同的pH值,一元弱酸的濃度必須比強酸大,由于體積相等,因此一元弱酸的物質的量大于強酸,因此產生的H2也比強酸多,據此可排除a、b;開始時H+濃度相等,因此反應速率也相等(在圖中反應速率就是斜率),隨著反應進行由于H+不斷被消耗掉,促使一元弱酸繼續電離,這就延緩了H+濃度下降的速率,此時弱酸的反應速率就要大于強酸的反應速率,且最終生成H2的體積一元弱酸大,故選c;
(5)將0.1molL-1的CH3COOH加水稀釋,溶液濃度減小,體積增大,醋酸的電離平衡右移,
a、加水后,醋酸的電離平衡右移,故電離程度增大,故a正確;
b.加水后,電離平衡右移,故溶液中離子總數增多,故b正確;
c.加水后,雖然電離出的離子的物質的量增多,但溶液體積增大,濃度減小,故溶液導電性減弱,故c錯誤;
d.加水后,電離平衡右移,則溶液中醋酸分子減少,故d錯誤。
故選ab。


 開心快樂假期作業暑假作業西安出版社系列答案
開心快樂假期作業暑假作業西安出版社系列答案科目:高中化學 來源: 題型:
【題目】下列關于有機物的敘述中正確的是( )
A. 油脂在稀硫酸或氫氧化鈉溶液中均可發生水解反應,但是水解產物相同
B. 取淀粉與稀硫酸共熱后的溶液,加入新制銀氨溶液共熱,沒有銀鏡產生,說明淀粉尚未水解生成葡萄糖
C. 結構式為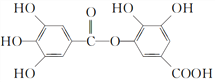 的有機物,可以在稀硫酸催化下發生水解反應,但水解產物只有一種
的有機物,可以在稀硫酸催化下發生水解反應,但水解產物只有一種
D. 纖維素、蔗糖、葡萄糖、蛋白質在一定條件下均可發生水解
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在0.1 mol·L-1 CH3COOH溶液中存在如下電離平衡: CH3COOH ![]() CH3COO-+H+,對于該平衡,下列敘述正確的是( )
CH3COO-+H+,對于該平衡,下列敘述正確的是( )
A. 加入水時,平衡向逆反應方向移動
B. 加入少量NaOH固體,平衡向正反應方向移動
C. 加入少量0.1 mol·L-1 HCl溶液,溶液中c(H+)減小
D. 加入少量CH3COONa固體,平衡向正反應方向移動
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某天然油脂A的分子式為C57H106O6。1mol該油脂完全水解可得到1mol甘油、1mol不飽和脂肪酸B和2mol直鏈飽和脂肪酸C。經測定B的相對分子質量為280,原子個數比為N(C):N(H):N(O)=9:16:1。
(1)寫出B的分子式:__。
(2)寫出C的結構簡式:__,C的名稱是__。
(3)寫出含5個碳原子的C的同系物可能的結構簡式:__。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鋁在酸性或堿性溶液中均可與NO3—發生氧化還原反應,轉化關系如下圖所示:
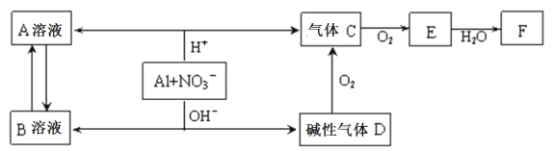
下列說法錯誤的是
A.B溶液含[Al(OH)4]—
B.A溶液和B溶液混合無明顯現象
C.D與F反應生成鹽
D.E排入大氣中會造成污染
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】海洋是資源的寶庫,醢藏著豐富的化學元素,如氯、溴、碘等,海洋資源的綜合利用具有非常廣闊的前景。
(1)下列說法正確的是_________。
a.AgCl、AgBr、AgI的顏色依次變深 b.F、Cl、Br、I的非金屬性依次增強
c.HF、HCl、HBr、HI的還原性的依次增強 d.F2、Cl2、Br2、I2與H2化合由難變易
(2)實驗室從海藻灰中提取少量碘的流程如下圖:
![]()
①氧化時,可以加入MnO2在酸性條件下進行氧化,反應的離子方程式為:_________。
②上述步驟①②③分離操作分別為過濾、_________、_________。
(3)從海水提取的粗鹽中含有Mg2+、Fe2+、Ca2+和SO42—等雜質,“除雜”所需試劑有:①過量的NaOH溶液②過量的Na2CO3溶液③適量的鹽酸④過量的BaCl2溶液.試劑的添加順序為_________。
為使Ca2+完全沉淀,溶液中c(CO32—)應不小于_________mol/L。[已知Ksp(CaCO3)=2.9×10-9,離子濃度小于1×10-5mol/L視為完全沉淀]
(4)目前,利用食鹽制取純堿主要有“氨堿法”和“聯合制堿法”兩種工藝

①能析出 NaHCO3的原因是_________。
②“氨堿法”是在濾液中加入_________產生NH3,循環使用,但產生大量的度棄物CaCl2;“聯合制堿法“是在濾液中繼續通入NH3,并加入NaCl粉末以制得更多的副產物_________。
③常溫下,向飽和食鹽水中通入NH3和CO2,當(HCO3—)=c(NH4+)時,溶液的pH_____7 (填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鏈狀高分子化合物![]() 可由有機化工原料
可由有機化工原料![]() 和其他無機試劑通過加成反應、水解反應、氧化反應、縮聚反應制得,則
和其他無機試劑通過加成反應、水解反應、氧化反應、縮聚反應制得,則![]() 是( )
是( )
A.乙醇B.![]() 丁醇C.乙烯D.1,
丁醇C.乙烯D.1,![]() 丁二烯
丁二烯
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列關于有機化合物的說法正確的是( )
A.相對分子質量為72的某烷烴,一氯代物有4種
B.四苯基乙烯![]() 中所有碳原子一定處于同一平面
中所有碳原子一定處于同一平面
C.在一定條件下,苯與液溴、濃硝酸生成溴苯、硝基苯的反應都屬于取代反應
D.![]() 和
和![]() 分子組成相差一個“-CH2-”,因此是同系物
分子組成相差一個“-CH2-”,因此是同系物
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com