
【題目】部分等電子體類型、代表物質及對應的空間構型如表所示:
等電子類型 | 代表物質 | 空間構型 |
四原子24電子等電子體 | SO3 | 平面三角形 |
四原子26電子等電子體 | SO32- | 三角錐形 |
五原子32電子等電子體 | CCl4 | 四面體形 |
六原子40電子等電子體 | PCl5 | 三角雙錐形 |
七原子48電子等電子體 | SF6 | 八面體形 |
請回答下列問題。
(1)請寫出下列離子的空間構型:
![]() ____________________,
____________________,![]() ____________________,
____________________,![]() ____________________。
____________________。
(2)由第2周期元素原子構成,與F2互為等電子體的離子是__________。
(3)![]() 的空間構型如圖1所示,請再按照圖1的表示方法在圖2中表示出
的空間構型如圖1所示,請再按照圖1的表示方法在圖2中表示出![]() 分子中O、S、F原子的空間位置。已知
分子中O、S、F原子的空間位置。已知![]() 分子中O、S間為共價雙鍵,S、F間為共價單鍵。__________。
分子中O、S間為共價雙鍵,S、F間為共價單鍵。__________。

【答案】三角錐形 平面三角形 四面體形 ![]()

【解析】
(1)判斷離子的空間構型時,需尋找等電子體:![]() 價電子數為26,與SO32-互為等電子體,所以空間構型為三角錐形;
價電子數為26,與SO32-互為等電子體,所以空間構型為三角錐形;![]() 的價電子數為24,與SO3互為等電子體,所以空間構型為平面三角形;
的價電子數為24,與SO3互為等電子體,所以空間構型為平面三角形;![]() 的價電子數為32,與CCl4互為等電子體,所以空間構型為四面體形。答案為:三角錐形;平面三角形;四面體形;
的價電子數為32,與CCl4互為等電子體,所以空間構型為四面體形。答案為:三角錐形;平面三角形;四面體形;
(2)由第2周期元素原子構成,與F2互為等電子體的離子,可從C、N、O進行分析,如O元素,構成![]() 。答案為:
。答案為:![]() ;
;
(3)已知![]() 分子中O、S間為共價雙鍵,S、F間為共價單鍵。
分子中O、S間為共價雙鍵,S、F間為共價單鍵。![]() 含有6個原子,價電子數為40,與PCl5互為等電子體,則結構為三角雙錐形,4個S—F鍵的鍵長相同,另含1個S=O鍵,則應為PCl5分子中位于同一平面內的2個S—F鍵被S=O鍵所替代,從而得出PCl5的空間構型為
含有6個原子,價電子數為40,與PCl5互為等電子體,則結構為三角雙錐形,4個S—F鍵的鍵長相同,另含1個S=O鍵,則應為PCl5分子中位于同一平面內的2個S—F鍵被S=O鍵所替代,從而得出PCl5的空間構型為 。
。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:
【題目】現有五種元素,其中A、B、C為短周期主族元素,D、E為第四周期元素,它們的原子序數依次增大。請根據下列相關信息回答問題:
A元素原子的核外電子數和電子層數相等
B元素原子的核外p電子數比s電子數少1
C元素的第一至第四電離能如下:![]()
![]()
![]()
![]()
D是前四周期中金屬性最強的元素
E在周期表的第七列
(1)已知BA5為離子化合物,寫出其電子式:__________。
(2)B元素基態原子中能量最高的電子,其電子云在空間有___個伸展方向,原子軌道呈 _____ 形。
(3)某同學根據上述信息,推斷C元素基態原子的軌道表示式為 ,該同學所畫的軌道表示式違背了 __________________ 。
,該同學所畫的軌道表示式違背了 __________________ 。
(4)E位于第 _________ 族、 _____ 區,該元素原子的核外電子排布式為 _______。
(5)檢驗D元素的方法是 _____ ,請用原子結構的知識解釋產生此現象的原因:__________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】處理、回收利用CO是環境科學家研究的熱點課題。回答下列問題:
Ⅰ.處理大氣污染物
CO用于處理大氣污染物N2O所發生的反應原理為:![]()
![]() 有人提出上述反應可以用“Fe+”作催化劑。
有人提出上述反應可以用“Fe+”作催化劑。
其總反應分兩步進行:(1)第一步:![]() ;第二步:____ (寫反應方程式)。
;第二步:____ (寫反應方程式)。
(2)第二步反應不影響總反應達到平衡所用時間,由此推知,第二步反應速率____ 第一步反應速率(填“大于”“小于”或“等于”)。
Ⅱ.合成天然氣(SNG)涉及的主要反應原理如下:
CO甲烷化: ![]()
![]()
水煤氣變換: ![]()
![]()
(3)反應![]() 的△H= ___kJ/mol。
的△H= ___kJ/mol。
(4)在一恒容容器中,按照nmolCO和3nmolH2投料發生CO甲烷化反應,測得CO在不同溫度下的平衡轉化率與壓強的關系如右圖所示,下列說法正確的是_____(填標號)。

a.溫度:T1<T2<T3
b.正反應速率:v(e)>v(c)>v(b)
c.平衡常數:K(a)<K(d)<K(c)
d.平均摩爾質量:M(a)>M(b)=M(e)
(5)在恒壓管道反應器中,按n(H2)︰n(CO)=3︰1通入原料氣發生CO甲烷化反應,400℃、P總為100kPa時反應體系平衡組成如下表所示。
組分 | H2 | CO | CH4 | H2O | CO2 |
體積分數 | 8.50 | 1.50 | 45.0 | 44.0 | 1.00 |
則該條件下CO的總轉化率α= ___。 (保留一位小數)
(6)將制備的CH4用來組成下圖所示燃料電池電解制備N2O5

①陽極的電極反應為_____。
②理論上制備1molN2O5,石墨2電極消耗氣體的體積為_____L(標準狀況)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】聚氨酯類高分子材料PU用途廣泛,其合成反應為n![]() +(n+1)HO(CH2)4OH
+(n+1)HO(CH2)4OH![]()
![]() 。下列說法錯誤的是( )
。下列說法錯誤的是( )
A.![]() 的沸點高于
的沸點高于![]()
B.高分子材料PU在強酸、強堿條件下能穩定存在
C.合成PU的兩種單體的核磁共振氫譜中均有3組吸收峰
D.以1,![]() 丁二烯為原料,可合成
丁二烯為原料,可合成![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】![]() 是一種可降解的聚酯類高分子材料,可由馬來酸酐等原料經如圖所示路線合成:
是一種可降解的聚酯類高分子材料,可由馬來酸酐等原料經如圖所示路線合成:
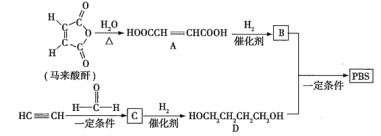
已知: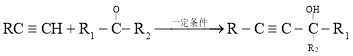 。
。
(1)![]() 的反應類型是___________;
的反應類型是___________;![]() 的結構簡式是___________________。
的結構簡式是___________________。
(2)![]() 中含有的官能團的名稱是______________;
中含有的官能團的名稱是______________;![]() 的名稱(按系統命名法)是___________________。
的名稱(按系統命名法)是___________________。
(3)半方酸是馬來酸酐的同分異構體,分子中含有1個環(四元碳環)和1個羥基,但不含![]() 結構,半方酸的結構簡式是_____________________。
結構,半方酸的結構簡式是_____________________。
(4)由![]() 和
和![]() 合成
合成![]() 的化學方程式是____________________________。
的化學方程式是____________________________。
(5)下列關于![]() 的說法正確的有_____________(填序號)。
的說法正確的有_____________(填序號)。
a.能使酸性![]() 溶液、溴的
溶液、溴的![]() 溶液褪色
溶液褪色
b.能與![]() 溶液反應,但不與
溶液反應,但不與![]() 反應
反應
c.能與新制![]() 懸濁液反應
懸濁液反應
d.![]() 完全燃燒消耗
完全燃燒消耗![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關說法正確的是
A.1 mol Cl2參加反應轉移電子數一定為2NA
B.在反應KIO3 + 6HI = KI + 3I2 +3H2O中,每生成3 mol I2轉移的電子數為6NA
C.根據反應中HNO3(稀)![]() NO,而HNO3(濃)
NO,而HNO3(濃)![]() NO2可知,氧化性:HNO3(稀) > HNO3(濃)
NO2可知,氧化性:HNO3(稀) > HNO3(濃)
D.含有大量NO3-的溶液中,不能同時大量存在H+、Fe2+、Cl-
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某些共價鍵的鍵長數據如下表所示。試根據下表回答問題。
共價鍵 |
|
|
|
|
|
|
|
|
鍵長 | 0.154 | 0.134 | 0.121 | 0.143 | 0.123 | 0.146 | 0.122 | 0.110 |
(1)根據表中有關數據,你能推斷出影響共價鍵鍵長的因素主要有哪些?_______。其影響的結果怎樣?__________。
(2)通常,鍵能越__________,共價鍵越____,由該鍵構成的分子越穩定。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】F2和Xe在一定條件下可生成XeF2、XeF4和XeF6三種氟化氙,它們都是極強的氧化劑(其氧化性依次增強),都極易與水反應。已知![]() ,下列推測正確的是( )
,下列推測正確的是( )
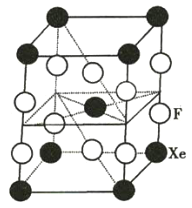
A.XeF2分子中各原子均達到8電子的穩定結構
B.某種氟化氙晶體的基本結構單元如圖所示,可推知其化學式為XeF6
C.XeF4與水反應時,每生成2 mol Xe轉移8 mol電子
D.XeF2加入水中,在水的作用下,將生成Xe和F2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】短周期元素A、B、D、E的原子序數依次增大,B、E位于同主族,四種元素的一種化合物的結構式如圖所示。下列說法不正確的是
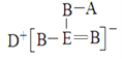
A.B的最簡單氫化物的沸點比E的高
B.D和E形成的三核二元化合物的水溶液中,陰、陽離子的濃度之比小于1:2
C.化合物DA的水溶液呈堿性
D.同時含有A、B、D、E四種元素的鹽至少有兩種
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com