
【題目】某銀白色金屬單質A在空氣中加熱燃燒時發出黃色火焰,得到淡黃色固體B,A暴露在空氣中足夠長時間變為C,B和酸性氣體D能生成C,A和B都能與水生成E,E和D也能生成C。回答下列問題。
(1)寫出下列物質的化學式:C_____________,D_____________,E_____________。
(2)寫出下列反應的化學方程式:
①A和水生成E:______________________________________________________;
②B和D生成C:______________________________________________________;
③A在空氣中加熱:___________________________________________________。
【答案】Na2CO3 CO2 NaOH 2Na+2H2O═2NaOH+H2↑ 2Na2O2+2CO2═2Na2CO3+O2 2Na+O2![]() Na2O2
Na2O2
【解析】
某銀白色金屬單質A在空氣中加熱燃燒時發出黃色火焰,得到淡黃色固體B,則A是Na、B是Na2O2,A露置在空氣中足夠長時間變為C,銀白色(鈉的真面目)→變暗(生成Na2O)→變白色固體(生成NaOH)→成液(NaOH潮解)→結塊(吸收CO2成Na2CO310H2O)→最后變成Na2CO3粉(風化),有關反應有:4Na+O2=2Na2O、Na2O+H2O=2NaOH、2NaOH+CO2=Na2CO3+H2O、Na2CO3+10H2O=Na2CO310H2O、Na2CO310H2O=Na2CO3+10H2O,則C是Na2CO3,B和酸性氣體D能生成C,則D是CO2,A和B都能與水生成E,則E是NaOH;據此分析可得結論。
(1)通過以上分析知,A、B、C、D、E分別是Na、Na2O2、Na2CO3、CO2、NaOH,
故答案為:Na2CO3、CO2、NaOH;
(2)①鈉和水反應生成NaOH和氫氣,反應方程式為:2Na+2H2O=2NaOH+H2↑,
故答案為:2Na+2H2O=2NaOH+H2↑;
②過氧化鈉和二氧化碳反應生成碳酸鈉和氧氣,反應方程式為:2Na2O2+2CO2=2Na2CO3+O2,故答案為:2Na2O2+2CO2=2Na2CO3+O2;
③鈉在空氣中加熱生成過氧化鈉,反應方程式為:2Na+O2![]() Na2O2。
Na2O2。


科目:高中化學 來源: 題型:
【題目】甲醇是重要的化工原料。利用合成氣(主要成分為CO、CO2和H2)在催化劑的作用下合成甲醇,可能發生的反應如下:
i. CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H1
CH3OH(g)+H2O(g) △H1
ii. CO2(g)+ H2(g)![]() CO(g)+H2O(g) △H2
CO(g)+H2O(g) △H2
iii. CH3OH(g)![]() CO(g) +2H2(g) △H3
CO(g) +2H2(g) △H3
回答下列問題:
(1)已知反應ⅱ中相關化學鍵鍵能數據如下:

由此計算△H2=__________kJ·mol-1。已知△H3=99kJ·mol-1,則△H1=_________kJ·mol-1。
(2)一定比例的合成氣在裝有催化劑的反應器中反應12小時。體系中甲醇的產率和催化劑的催化活性與溫度的關系如圖1所示。

①溫度為470K時,圖中P點_______ (填“是”或“不是”)處于平衡狀態。在490K之前,甲醇產率隨著溫度升高而增大的原因是_______;490K之后,甲醇產率下降的原因是_______。
②一定能提高甲醇產率的措施是______________。
A.增大壓強 B,升高溫度 C.選擇合適催化劑 D.加入大量催化劑
(3)圖2為一定比例的CO2/H2,CO/H2、CO/CO2/H2條件下甲醇生成速率與溫度的關系。
①490K時,根據曲線a、c判斷合成甲醇的反應機理是_________ (填“I”或“II")。
![]()
②490K時,曲線a與曲線b相比,CO的存在使甲醇生成速率增大,從熱力學與動力學角度,并結合反應i、ⅱ分析原因_________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】四碘化錫(SnI4)是一種橙紅色固體,熔點為144.5℃,沸點為364℃,易水解,易溶于有機溶劑,實驗室通過如圖所示裝置用錫和碘單質制備SnI4,實驗步驟如下:
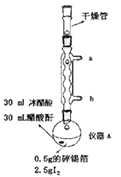
一、洗滌并干燥儀器,然后按照圖中標注用量向儀器A中加入各種藥品并組裝儀器。
二、通入冷凝水,加熱儀器A至裝置中紫色蒸氣消失,溶液顏色由紫紅色變為橙紅色。
三、停止加熱,趁熱過濾除去固體雜質,將濾液在燒杯中冷卻析出晶體。
四、對所得晶體進行重結晶,過濾、洗滌、干燥、稱量。
請回答下列相關問題:
(1)儀器A的名稱是__________________,裝置中球形冷凝管的作用是__________________,其效果優于直形冷凝管的原因是__________________。
(2)從實驗步驟及裝置圖分析,實驗過程中主要目的是防止SnI4水解的操作有___________、_______。
(3)若最終所得晶體的質量為2.2g,則錫的轉化率為_______________(保留三位有效數字)。
(4)SnI4遇水發生復分解反應生成一種白色沉淀和一種強酸,檢驗反應后所得的溶液中的陰離子的常用方法有以下三種,請補充其中所缺試劑。
①沉淀法:稀硝酸和________________;②置換--萃取法;新制氯水和__________________;③利用該元素對應單質的某種特征反應:新制氯水和____________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】電解裝置如圖所示,電解槽內裝有 KI 及淀粉溶液,中間用陰離子交換膜 隔開.在一定的電壓下通電,發現左側溶液變藍色,一段時間后,藍色逐漸變 淺。已知:3I2+6OH﹣=IO3﹣+5I﹣+3H2O,下列說法不正確的是( )
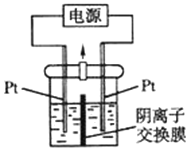
A. 右側發生的電極反應式:2H2O+2e﹣=H2↑+2OH﹣
B. 電解結束后,右側溶液中含有 IO3﹣
C. 電解槽內發生反應的總化學方程式:KI+3H2O![]() KIO3+3H2↑
KIO3+3H2↑
D. 如果用陽離子交換膜代替陰離子交換膜,電解槽內發生的總化學方程式不變
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】興趣小組在實驗室用制備的氯氣與一氧化氮在常溫常壓下合成亞硝酰氯。
【查閱資料】 亞硝酰氯(NOCl,熔點:-64.5 ℃,沸點:-5.5 ℃) 是一種黃色氣體,液體狀態呈紅褐色,遇水易水解。可用于合成清潔劑、觸媒劑及中間體等。對眼睛、皮膚和粘膜有強烈刺激性,具有類似氯氣和氮氧化物的毒作用。冰水中加入NaCl可降低溫度。
【原料制備】 在實驗室分別制備原料氣NO和Cl2。
(1)用如下裝置制備純凈干燥的氣體,請補充下表中各儀器中的試劑。
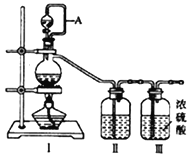
原料制備 | 裝置Ⅰ | 裝置Ⅰ | 裝置Ⅱ |
燒瓶中 | 分液漏斗中 | ||
制備純凈Cl2 | MnO2 | ①__________ | ②______ |
制備純凈NO | Cu | ③_______ | ④_________ |
【合成亞硝酰氯】 利用制得的NO和Cl2制備NOCl,裝置如圖所示:
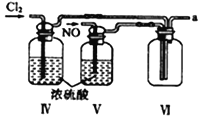
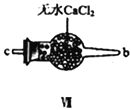
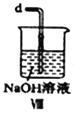
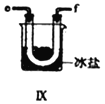
(2)裝置Ⅳ、Ⅴ除可進一步干燥NO、Cl2外,另一個作用是___________________。
(3)裝置連順序為 a→_______________(按氣流自左向右方向,用小寫字母表示)。
(4)裝置Ⅴ的作用是___________________________________。
(5)裝置Ⅸ在實驗時,預期觀察到的現象是__________________________________________。
(6)裝置Ⅷ中吸收尾氣時,NOCl發生反應的化學方程式為________________________。
【拓展學習】
(7)查閱資料,得知配制王水(濃硝酸與濃鹽酸的混酸) 時會生成亞硝酰氯和氯氣,該反應的化學方程式為__________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法中正確的是( )
A.苯和乙烷都能發生取代反應
B.石油的分餾和煤的干餾都是化學變化
C.工業上可通過石油分餾直接得到甲烷、乙烯和苯
D.乙烯和聚乙烯都能使溴的四氯化碳溶液褪色
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列離子檢驗的方法正確的是
A. 某溶液![]() 有白色沉淀,說明原溶液中有Cl-
有白色沉淀,說明原溶液中有Cl-
B. 某溶液![]() 有藍色沉淀,說明原溶液中有Cu2+
有藍色沉淀,說明原溶液中有Cu2+
C. 某溶液![]() 有白色沉淀,說明原溶液中有SO42-
有白色沉淀,說明原溶液中有SO42-
D. 某溶液![]() 生成無色氣體,說明原溶液中有CO32-
生成無色氣體,說明原溶液中有CO32-
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】為維持人體血液中的血糖含量,在給病人輸液時,通常用葡萄糖注射液。右圖是醫院病人輸液使用的一瓶質量分數為5%的葡萄糖(C6H12O6)注射液標簽,請認真觀察標簽上所列內容后列式計算(要求寫出計算過程):

(1)該溶液的物質的量濃度為_________ mol·L-1(結果保留2位有效數字);
(2)該溶液的密度為__________ g·mL-1;
(3)如果從該瓶中取出75g葡萄糖注射液,將其變為15%的注射液,需要加入______g葡萄糖固體(質量精確到0.1g)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在兩個容積相同的容器中,一個盛有NH3,另一個盛有N2、H2的混合氣體,在同溫同壓下,兩容器內的氣體一定具有相同的
A. 原子數 B. 分子數 C. 質量 D. 密度
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com