
【題目】化合物![]() (甲)、
(甲)、 (乙)、
(乙)、 (丙)的分子式均為C8H8,下列說法不正確的是
(丙)的分子式均為C8H8,下列說法不正確的是
A. 甲、乙、丙在空氣口燃燒時均產生明亮并帶有濃煙的火焰
B. 甲、乙、丙中只有甲的所有原子可能處于同一平面
C. 等量的甲和乙分別與足量的溴水反應,消耗Br2的量:甲>乙
D. 甲、乙、丙的二氯代物數目最少的是丙
【答案】C
【解析】分析:本題考查烴的分子結構和性質,涉及燃燒、原子共面問題、反應物耗量多少的分析和同分異構體的判斷。
詳解:A. 甲、乙、丙分子式均為C8H8,含碳量高,燃燒時均產生明亮并帶有濃煙的火焰,故A正確;B.甲烷是正四面體結構,乙、丙中含有類似于甲烷飽和碳原子,所有原子不可能處于同一平面,甲中含有苯環和碳碳雙鍵,由于連接的碳碳單鍵可以旋轉,兩個平面可以重合,所以只有甲的所有原子可能處于同一平面,B正確;C.苯環不和溴水反應,甲和乙與溴水反應是碳碳雙鍵上的加成反應,由于乙中含有3個碳碳雙鍵,所以消耗Br2的量:甲<乙,C錯誤;D. 由于丙的對稱性最好,故二氯代物數目最少的是丙,只有三種,故D錯誤;綜合以上分析,本題答案為C。


 名校名師培優作業本加核心試卷系列答案
名校名師培優作業本加核心試卷系列答案 全程金卷系列答案
全程金卷系列答案科目:高中化學 來源: 題型:
【題目】科學家發現對冶金硅進行電解精煉提純可降低高純硅制備成本。相關電解槽裝置如圖所示,用Cu-Si合金作硅源,在950℃利用三層液熔鹽進行電解精煉,有關說法不正確的是
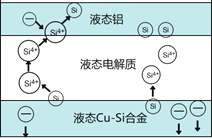
A. 在該液相熔體中Cu優先于Si被氧化,Si4+優先于Cu2+被還原
B. 電子由液態Cu-Si合金流出,從液態鋁流入
C. 三層液熔鹽的作用是增大電解反應面積,提高硅沉積效率
D. 電流強度不同,會影響硅提純速率
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】欲測定某NaOH溶液的物質的量濃度,可用0.1000mol·L-1HCl標準溶液進行中和滴定(用甲基橙作指示劑)。
請回答下列問題:
(1)滴定時,盛裝待測NaOH溶液的儀器名稱為 ,盛裝標準鹽酸的儀器名稱為 ;滴定至終點的顏色變化為 。
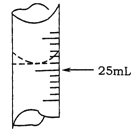
(2)若甲學生在實驗過程中,記錄滴定前滴定管內液面讀數為0.50mL,滴定后液面如圖,則此時消耗標準溶液的體積為 。
(3)乙學生做了三組平行實驗,數據記錄如下:
實驗序號 | 待測NaOH溶液的體積/mL | 0.1000mol·L-1HCl溶液的體積/mL | |
滴定前刻度 | 滴定后刻度 | ||
1 | 25.00 | 0.00 | 26.29 |
2 | 25.00 | 1.56 | 31.30 |
3 | 25.00 | 1.00 | 27.31 |
選取上述合理數據,計算出待測NaOH溶液的物質的量濃度為 (保留四位有效數字)。
(4)下列哪些操作會使測定結果偏高 (填序號)。
A.錐形瓶用蒸餾水洗凈后再用待測液潤洗
B.酸式滴定管用蒸餾水洗凈后再用標準液潤洗
C.滴定前酸式滴定管尖端氣泡未排除,滴定后氣泡消失
D.滴定前讀數正確,滴定后俯視滴定管讀數
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】NA 表示阿伏加德羅常數,下列說法不正確的是( )
A. 4.6 克金屬鈉與 500mL0.2molL-1 稀鹽酸反應,轉移電子數為 0.1NA
B. 0.012kg12C 含有 NA 個 12C 原子
C. 等 物 質 的 量 的OH- 與 NH4+ 所 含 電 子 數 相 同
D. 標準狀況下,以任意比例混合的 CH4 和 CO2 混合物 22.4L,含有的碳原子數約為 NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某微粒的核外電子排布式為1s22s22p63s23p6,下列關于該微粒的說法正確的是( )
A.它的質子數一定是18
B.它的原子和37Cl可能互為同位數
C.它的單質一定是強還原劑
D.可以確定該微粒為Ar
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(12分)二氧化碳是用途非常廣泛的化工基礎原料,回答下列問題:
(1)工業上可以用CO2來生產燃料甲醇。
已知:CO2(g)+3H2(g)![]() CH3OH(l)+H2O(l) △H=-130kJ·mol-1
CH3OH(l)+H2O(l) △H=-130kJ·mol-1
2H2(g)+O2(g)=2H2O(l) △H=-572kJ·mol-1
CH3OH(l)的燃燒熱△H=___________。
(2)在催化劑作用下,CO2和CH4可直接轉化為乙酸:CO2(g)+CH4(g)=CH3COOH(g) △H>0在不同溫度下乙酸的生成速率變化如圖所示。
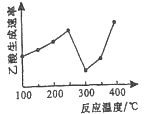
①當溫度在250℃—300℃范圍時,乙酸的生成速率減慢的主要原因是_________。
②欲使乙酸的平衡產率提高,應采取的措施是_____________(任寫一條措施即可)。
(3)一定條件下,在密閉容器中發生反應:2CO(g)![]() C(s)+CO2(g)。
C(s)+CO2(g)。
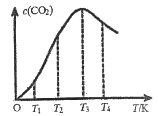
①下列能說明該反應達到平衡的是___________。
A.容器內混合物的質量不變
B.CO和CO2的物質的量之比不再變化
C.混合氣體的平均摩爾質量不再變化
D.形成amolC=O鍵的同時斷裂amolC![]() O鍵
O鍵
②向某恒容容器中通入一定量的CO發生上述反應,在不同溫度下CO2的物質的量濃度c(CO2)隨溫度的變化如上圖所示,則該反應為________(填“放熱”或“吸熱”)反應。
③向容積可變的某恒壓容器中通入amolCO,TC時反應經過10min達平衡,CO的體積分數為75%。CO的平衡轉化率為_______。在容積改變的條件下,反應速率可用單位時間內反應物或生成物的物質的量變化來表示,則0-10min內平均反應速率v(CO2)=__________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在下列中學化學中常見物質的轉化關系圖中,反應條件及部分反應物和產物未全部注明,已知 A 是黑色固體單質,D 為日常生活中常見的金屬單質,其它均為化合物,且 B 為有磁性的黑色固體,L 為紅棕色固體。請回答下列問題:

⑴寫出 C 的結構式_________
⑵寫出下列物質的化學式: B:_________ E:_________
⑶寫出下列反應的化學方程式或離子方程式:E→F 的化學方程式_________ G→H 的離子方程式_________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某同學設計了如下裝置用于制取 SO2 和驗證 SO2 的性質。
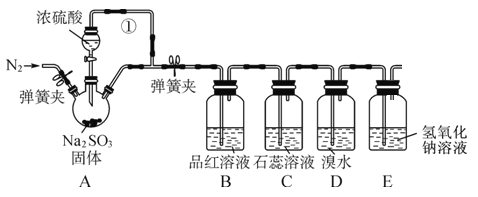
試回答以下問題:
(1)裝置 A 中用于添加濃硫酸的儀器名稱為____,其中反應的化學方程式為____。
(2)導管①的作用是____。
(3)裝置 B 中可觀察到的現象是____,體現出 SO2 ____性。
(4)裝置 D 中溴水褪色,體現出 SO2 ____性。
(5)E 裝置的作用是 ____,發生反應的離子方程式為____。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com