
【題目】NA為阿伏加德羅常數的值。下列說法正確的是
A. 1L0.5mol/L碳酸鈉溶液中含有的CO32-離子數為0.5NA
B. 5.6gFe與稀硝酸完全反應,轉移的電子數可能為0.2NA
C. 3.2g甲醇中的羥基所含電子數為NA
D. 密閉容器中1molN2與3molH2充分反應,產物分子數為2NA
【答案】B
【解析】A,n(Na2CO3)=0.5mol/L![]() 1L=0.5mol,在溶液中由于CO32-的水解,CO32-物質的量小于0.5mol,A項錯誤;B,n(Fe)=
1L=0.5mol,在溶液中由于CO32-的水解,CO32-物質的量小于0.5mol,A項錯誤;B,n(Fe)=![]() =0.1mol,若發生反應3Fe+8HNO3(稀)=3Fe(NO3)2+2NO↑+4H2O,反應中轉移0.2mol電子,若發生反應Fe+4HNO3(稀)=Fe(NO3)3+NO↑+2H2O,反應中轉移0.3mol電子,若生成Fe(NO3)2和Fe(NO3)3,轉移電子數介于0.2mol~0.3mol,B項正確;C,n(CH3OH)=
=0.1mol,若發生反應3Fe+8HNO3(稀)=3Fe(NO3)2+2NO↑+4H2O,反應中轉移0.2mol電子,若發生反應Fe+4HNO3(稀)=Fe(NO3)3+NO↑+2H2O,反應中轉移0.3mol電子,若生成Fe(NO3)2和Fe(NO3)3,轉移電子數介于0.2mol~0.3mol,B項正確;C,n(CH3OH)=![]() =0.1mol,含羥基0.1mol,0.1mol羥基中所含電子物質的量為0.9mol,C項錯誤;D,N2與H2合成NH3為可逆反應,則1molN2與3molH2充分反應生成的NH3物質的量小于2mol,D項錯誤;答案選B。
=0.1mol,含羥基0.1mol,0.1mol羥基中所含電子物質的量為0.9mol,C項錯誤;D,N2與H2合成NH3為可逆反應,則1molN2與3molH2充分反應生成的NH3物質的量小于2mol,D項錯誤;答案選B。


科目:高中化學 來源: 題型:
【題目】完成下列各小題。
(1)鐵是自然界分布最廣的金屬元素之一,在地殼中的質量約占5%左右。鐵礦石的種類很多,重要的有磁鐵礦石、赤鐵礦石等。
①寫出赤鐵礦主要成分的化學式___________________;
②紅熱的鐵能跟水蒸氣反應,有一種產物是可燃性氣體,則其化學反應方程式為_______;
(2)寫出除去下列氣體中的雜質(括號內的氣體為雜質)所用的試劑,并寫出除雜的化學方程式。
CO2 (HCl) ______________;化學方程式:_________________。
(3)1774年,瑞典化學家舍勒在研究軟錳礦的過程中,制備出了一種黃綠色、有刺激性氣味的氣體。舍勒發現氯氣的方法至今還是實驗室制取氯氣的主要方法之一。寫出實驗室制取氯氣的化學方程式__________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知某酸H2B 在水溶液中存在下列關系:H2B=H++HB-,HB-![]() H++B2- 。則下列關于酸式鹽NaHB 溶液的說法中正確的是
H++B2- 。則下列關于酸式鹽NaHB 溶液的說法中正確的是
A. 電離方程式:NaHB=Na++H++B2-
B. NaHB 溶液可能呈酸性或堿性
C. NaHB 和NaOH 溶液反應的離子方程式:HB-+OH-= H2O+B2-
D. 該溶液中:c(Na+)=c(H2B)+c(HB-)+c(B2-)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】中華文化源遠流長、博大精深。從化學的視角看,下列理解不正確的是
A | B | C | D |
千淘萬漉雖辛苦,吹盡黃沙始到金。劉禹錫《浪淘沙》詩句 |
司母戊鼎 |
侯德榜 |
瓷器(China) |
詩句中“淘”“漉”相當于分離提純操作中的“過濾”。 | 屬青銅制品,是我國古代科技光輝成就的代表之一。 | 我國化學工業的奠基人,主要成就: 侯氏制堿法,該堿指的是燒堿。 | 屬硅酸鹽產品,China一詞又指“瓷器”,這反映了在西方人眼中中國作為“瓷器故鄉”的形象。 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】25℃時,在一定體積pH = 12的NaOH溶液中, 加入一定體積0.01 mol/L的NaHSO4溶液,此時混合溶液的pH = 11。若反應后溶液的體積等于NaOH 溶液與NaHSO4溶液的體積之和,則NaOH溶液與NaHSO4溶液的體積比是( )
A. 1∶9 B. 10∶1 C. 11∶9 D. 1∶2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】室溫下,用0.100 mol·L-1NaOH溶液分別滴定20.00 mL 0.100 mol·L-1的鹽酸和醋酸,滴定曲線如圖所示.下列說法正確的是( )
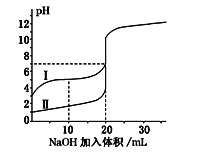
A. Ⅰ表示的是滴定鹽酸的曲線
B. pH=7時,滴定醋酸消耗的V(NaOH)小于20mL
C. V(NaOH)=20mL時,兩份溶液中c(Cl-)=c(CH3COO-)
D. V(NaOH)=10mL時,醋酸溶液中c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下面說法中,與鹽類水解無關的是( )
①NaHCO3做發酵粉時加入檸檬酸后效果更好
②FeCl2溶液中加入一定量的鐵粉
③實驗室配制AlCl3溶液,先把它溶解在鹽酸中,而后加水稀釋
④NH4F溶液不能保存在玻璃試劑瓶中
⑤實驗室盛放Na2CO3、Na2SiO3 等溶液的試劑瓶應用橡皮塞
⑥在NH4Cl或AlCl3 溶液中加入鎂條會產生氣泡
⑦Na2S溶液和AlCl3溶液反應得不到Al2S3
⑧室溫下NaHCO3飽和溶液pH約為8.4
⑨0.1 mol/L AlCl3溶液中c(Al3+)<0.1 mol/L
A. ②⑧ B. ①② C. ④⑧ D. 全有關
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鋁是當前應用最廣泛的金屬材料之一,鋁制品及其化合物在日常生活和工農業生產中也有著重要的用途。回答下列問題:
(1)基態鋁原子的核外電子排布式為____________。
(2)根據元素周期律等知識判斷,第一電離能Al____________Mg(填寫“大于”或“小于”)。
(3)Al2O3是常用的耐火材料,工業上也是用電解Al2O3方法制取金屬Al,據此判斷Al2O3的晶體類型是____________。
(4)LiAlH4是一種重要的有機合成試劑,AlH4-的立體構型為____________,LiAlH4中Al原子的雜化軌道類型為____________。
(5)金屬鋁的晶胞結構如圖1所示,原子之間相對位置關系的平面圖如圖2所示。
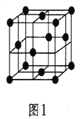
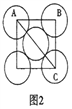
①晶體鋁中原子的堆積方式為____________。
②已知鋁原子半徑為acm,摩爾質量為Mg·mol-1,阿伏加德羅常數的值為NA,則晶體鋁的密度ρ=_______g·cm-3(用含a、M、NA的代數式來表示)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某風景區被稱為天然氧吧,其原因是空氣中的自由電子附著在分子或原子上形成空氣負離子,被稱為“空氣維生素”.O2﹣就是一種空氣負離子,其摩爾質量為( )
A.32g
B.33g
C.32gmol﹣1
D.33gmol﹣1
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com