
【題目】I、有A、B、C三種可溶性鹽,陰、陽離子各不相同,其陰離子的摩爾質量按A、B、C的順序依次增大。將等物質的量的A、B、C溶于水,所得溶液中只含有Fe3+、NH4+、SO![]() 、NO
、NO![]() 、Cl-五種離子,同時生成一種白色沉淀。請回答下列問題:
、Cl-五種離子,同時生成一種白色沉淀。請回答下列問題:
(1)經檢驗,三種鹽中還含有下列選項中的一種離子,該離子是____________。
A. Na+ B.Ba2+ C.Mg2+ D. Cu2+
(2)寫出C的化學式:C____________。
(3)若將A、B、C三種鹽按一定比例溶于水,所得溶液中只含有Fe3+、Cl-、NO![]() 、NH4+四種離子且物質的量之比依次為1∶1∶3∶1(不考慮水電離的影響)。則A、B、C三種鹽的物質的量之比為____________。若向B溶液中通入少量SO2氣體,有沉淀和無色氣體產生,該沉淀為 。
、NH4+四種離子且物質的量之比依次為1∶1∶3∶1(不考慮水電離的影響)。則A、B、C三種鹽的物質的量之比為____________。若向B溶液中通入少量SO2氣體,有沉淀和無色氣體產生,該沉淀為 。
II、已知某KNO3溶液A中,混有少量的Ca2+和SO![]() 等雜質,某同學設計了如下實驗方案以制得純凈的KNO3固體。
等雜質,某同學設計了如下實驗方案以制得純凈的KNO3固體。

根據上述回答:
(1)沉淀D中所含有的物質是 。
(2)按上述實驗方案制得的KNO3晶體,經分析測定仍含有雜質,其原因是上述第 步(填① ② ③)可能有誤,請加以改正: 。
【答案】I(1)B(2)Fe2(SO4)3
(3)2∶3∶1(2分)硫酸鋇(或BaSO4)
II(1)BaCO3和CaCO3
(2)③ 向E溶液中加入適量的HNO3溶液,再蒸發結晶(2分)
【解析】
試題分析:I.等物質的量的A、B、C溶于水,所得溶液中只含有Fe3+、NH4+、SO42-、NO3-、Cl-五種離子,同時生成一種白色沉淀,A、B、C三種可溶性正鹽,陰、陽離子各不相同,其陰離子的摩爾質量依次增大,則A為鹽酸鹽,B為硝酸銀,C為硫酸鹽;等物質的量混合,生成沉淀可能為BaSO4,則A為NH4Cl,B為Ba(NO3)2,C為Fe2(SO4)3 ,
(1)由上述分析可知,只有Ba2+與SO42-生成沉淀,故答案為B;
(2)由上述分析可知,A為NH4Cl,B為Ba(NO3)2,C為Fe2(SO4)3 ;
(3)若將A、B、C三種鹽按一定比例溶于水,所得溶液中只含有Fe3+、Cl-、NO![]() 、NH4+四種離子且物質的量之比依次為1∶1∶3∶1,令Fe3+、Cl-、NO
、NH4+四種離子且物質的量之比依次為1∶1∶3∶1,令Fe3+、Cl-、NO![]() 、NH4+四種離子的物質的量依次為1mol、1mol、3mol、1mol,同時SO42-和Ba2+恰好完全沉淀,則NH4Cl為1mol,Ba(NO3)2為1.5mol,Fe2(SO4)3為0.5mol,三者的物質的量之比為2∶3∶1;向Ba(NO3)2溶液里通入SO2,SO2在酸性條件下被NO3-氧化成SO42-,同時NO3-還原為NO,SO42-和Ba2+生成BaSO4沉淀。
、NH4+四種離子的物質的量依次為1mol、1mol、3mol、1mol,同時SO42-和Ba2+恰好完全沉淀,則NH4Cl為1mol,Ba(NO3)2為1.5mol,Fe2(SO4)3為0.5mol,三者的物質的量之比為2∶3∶1;向Ba(NO3)2溶液里通入SO2,SO2在酸性條件下被NO3-氧化成SO42-,同時NO3-還原為NO,SO42-和Ba2+生成BaSO4沉淀。
Ⅱ.溶液A中,混有少量的Ca2+和SO42-等雜質,由分離流程可知,加硝酸鋇,與硫酸根離子反應,則沉淀B為BaSO4,溶液C中含KNO3及Ca2+、Ba2+,再加碳酸鉀,反應生成的沉淀D為CaCO3、BaCO3,則溶液E中含KNO3及碳酸鉀,應加硝酸后蒸發結晶得到硝酸鉀晶體,
(1)由上述分析可知,沉淀D為CaCO3、BaCO3;
(2)第②步加入過量碳酸鉀溶液,第③步需除去溶液里有多余CO32,否則E中含碳酸鉀,具體操作是應加足量硝酸,再蒸發結晶。


 提分百分百檢測卷系列答案
提分百分百檢測卷系列答案科目:高中化學 來源: 題型:
【題目】已知硒元素的核電荷數為34,下列關于80Se的說法正確的是( )
A. 80Se的核外有34個電子 B. 80Se的質量數是46
C. 80Se的核內有34個中子 D. 80Se的核內有80個質子
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】100 mL 2 mol/L H2SO4與過量Zn粉反應,在一定溫度下,為了加快反應速率,但又不影響生成氫氣的總量,可以采取的措施是( )
A. 加入碳酸鈉固體
B. 改用18 mol/L的濃H2SO4
C. 滴入少量硫酸銅溶液
D. 加入硫酸鉀溶液
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一種含鋁、鋰、鈷的新型電子材料,生產中產生的廢料數量可觀,廢料中的鋁以金屬鋁箔的形式存在,鈷以Co2O3·CoO的形式存在,吸附在鋁箔的單面或雙面,鋰混雜于其中。從廢料中回收氧化鈷(CoO)工藝流程如下:
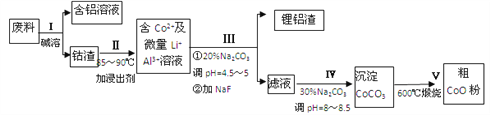
(1)過程Ⅰ中采用NaOH溶液溶出廢料中的Al,反應的離子方程式為________
(2)過程Ⅱ中加入稀H2SO4酸化后,再加入Na2S2O3溶液浸出鈷。則浸出鈷的化學反應方程式為 (產物中只有一種酸根)_________________
在實驗室模擬工業生產時,也可用鹽酸浸出鈷,但實際工業生產中不用 鹽酸,請從氧化還原和環境保護的角度分析不用鹽酸浸出鈷的主要原因是____________________
(3)過程Ⅲ得到鋰鋁渣的主要成分是LiF和Al(OH)3,碳酸鈉溶液在產生Al(OH)3時起重要作用,請寫出該反應的離子方程式__________________
(4)碳酸鈉溶液在過程Ⅲ和Ⅳ中所起作用有所不同,請寫出在過程Ⅳ中起的作用是______________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法中,能說明化學平衡一定向正反應方向移動的是
A、N2O4(g)![]() 2NO2(g),改變某一條件后,氣體顏色加深
2NO2(g),改變某一條件后,氣體顏色加深
B、H2(g)+I2(g)![]() 2HI(g),單位時間內消耗H2和HI的物質的量之比大于1:2
2HI(g),單位時間內消耗H2和HI的物質的量之比大于1:2
C、N2(g)+3H2(g)![]() 2NH3(g),改變某一條件后,NH3的體積分數增加
2NH3(g),改變某一條件后,NH3的體積分數增加
D、2SO2(g)+O2(g)![]() 2SO3(g),恒溫恒壓條件下,充入He
2SO3(g),恒溫恒壓條件下,充入He
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知可逆反應:M(g)+N(g)![]() P(g)+Q(g) △H> 0請回答下列問題
P(g)+Q(g) △H> 0請回答下列問題
(1)在某溫度下,反應物的起始濃度分別為c(M)=1mol/L,c(N)=2.4mol/L;達到平衡后,M的轉化率為60%,此時N的轉化率為____________
(2)若反應溫度升高,M的轉化率 (填“增大”、“減小”或“不變”)
(3)若反應溫度不變,反應物的起始濃度分別為c(M)=4mol/L,c(N)=amol/L;達到平衡后,c(P)=2mol/L,a=____________
(4)若反應溫度不變,反應物的起始濃度為c(M)=c(N)=bmol/L,達到平衡后,M的轉化率為____________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知Cl、S、P為三種原子序數相連的元素,則下列說法正確的是( )
A. 氣態氫化物的穩定性:HCl>H2S>PH3
B. 非金屬活潑性:S<Cl<P
C. 原子半徑:Cl>S>P
D. 原子序數:S<P<Cl
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法與鹽類水解無關的是
A. 粗鹽在空氣中易潮解 B. NH4Cl與ZnCl2用于金屬焊接中除銹
C. 用熱純堿溶液去油污 D. 蒸干并灼燒FeCl3溶液得到Fe2O3
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com