
【題目】工業煉鐵過程中涉及到的主要反應有:
①![]()
![]()
②![]()
![]()
③![]()
![]()
④![]()
![]()
回答下列問題:
(1)![]() ________
________![]() 。
。
(2)![]() 時,向容積為
時,向容積為![]() 的恒容密閉容器中加入
的恒容密閉容器中加入![]()
![]() 和
和![]()
![]() 發生反應③,5min時達到平衡,平衡時測得混合氣體中
發生反應③,5min時達到平衡,平衡時測得混合氣體中![]() 的體積分數為80%,則0~5min內反應的平均速率
的體積分數為80%,則0~5min內反應的平均速率![]() ________
________![]() ,該溫度下反應的平衡常數為________,下列選項中能夠說明該反應已經達到平衡狀態的是________(填標號)。
,該溫度下反應的平衡常數為________,下列選項中能夠說明該反應已經達到平衡狀態的是________(填標號)。
A.固體的物質的量不再變化
B.體系的壓強保持不變
C.混合氣體的平均摩爾質量保持不變
D.單位時間內消耗![]() 和生成
和生成![]() 的物質的量相等
的物質的量相等
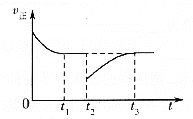
(3)一定條件下進行反應③,正向反應速率與時間的關系如圖所示,![]() 時刻改變了一個外界條件,可能是________。
時刻改變了一個外界條件,可能是________。
(4)向密閉容器中加入足量的![]() 、
、![]() 和一定量的
和一定量的![]() 、
、![]() ,在
,在![]() 和
和![]() 下,反應③體系中
下,反應③體系中![]() 和
和![]() 的分壓隨時間變化的關系如圖所示(已知溫度:
的分壓隨時間變化的關系如圖所示(已知溫度:![]() )
)
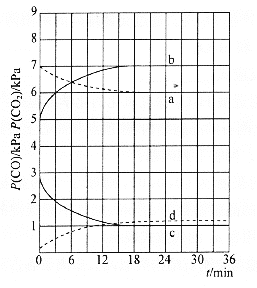
![]() 時,
時,![]() 隨時間變化關系的曲線是________,
隨時間變化關系的曲線是________,![]() 時,
時,![]() 隨時間變化關系的曲線是________。向
隨時間變化關系的曲線是________。向![]() 時已經達到平衡狀態的反應③體系中再充入一定量的
時已經達到平衡狀態的反應③體系中再充入一定量的![]() ,再次達到平衡時,
,再次達到平衡時,![]() 與
與![]() 的物質的量之比為________。
的物質的量之比為________。
【答案】-28 0.048 64 AC 恒壓條件下充入一定量![]() a c 1:7
a c 1:7
【解析】
(1)根據蓋斯定律進行ΔH3的計算;
(2)根據題干信息,列三段式求出CO轉化的物質的量,從而求出0~5min內的平均反應速率和平衡常數,根據分析“變量”來判斷是否能夠作為反應達到平衡的標志;
(3)結合化學反應速率和平衡移動的影響因素進行分析解答;
(4)結合第(2)中的平衡常數,根據CO和CO2的濃度比通過阿伏伽德羅定律得出三個溫度下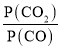 的大小關系,從而結合圖像分析得出代表曲線,在根據溫度不變,平衡常數不變求出比值。
的大小關系,從而結合圖像分析得出代表曲線,在根據溫度不變,平衡常數不變求出比值。
(1)由題干信息分析可得,反應③可通過反應![]() (④-②×3)得到,根據蓋斯定律,ΔH3=
(④-②×3)得到,根據蓋斯定律,ΔH3=![]() (ΔH4-3ΔH2)=
(ΔH4-3ΔH2)=![]() (460-3×172)=-28kJ·mol-1,故答案為:-28;
(460-3×172)=-28kJ·mol-1,故答案為:-28;
(2)T1時,向容積為10L的恒容密閉容器中加入3molFe2O3和3molCO發生反應③,平衡時測得混合氣體中CO2的體積分數為80%,設CO轉化了x mol,列三段式有:
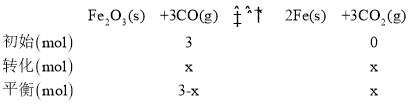
則![]() ,解得x=2.4mol,因此0~5min內反應的平均速率
,解得x=2.4mol,因此0~5min內反應的平均速率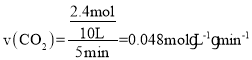 ,該溫度下的平衡常數
,該溫度下的平衡常數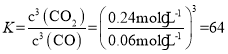 ;
;
A.由化學反應方程式可知,反應中固體的物質的量為一個變量,當固體的物質的量不再發生改變時,可以說明反應達到了平衡,A選項正確;
B.恒溫恒容時,由阿伏伽德羅定律PV=nRT可知,體系的壓強與氣體的物質的量成正比,因為反應中氣體的物質的量始終保持不變,所以體系壓強始終不變,故體系的壓強保持不變不能說明反應達到了平衡,B選項錯誤;
C.混合氣體的平均摩爾質量=混合氣體的總質量÷混合氣體的物質的量,反應前后混合氣體的總質量增加,總物質的量不變,則混合氣體的平均摩爾質量為一個變量,當混合氣體的平均摩爾質量保持不變時,可以說明反應達到了平衡,C選項正確;
D.單位時間內消耗CO和生成CO2都是正反應方向,不能說明反應達到了平衡,D選項錯誤;
答案選AC,故答案為:0.048;64;AC;
(3)由于該反應是一個反應前后氣體體積不變的且正反應是放熱的反應,根據圖像變化趨勢可知,在t2時v正減小,且重新平衡時等于原平衡的v正,平衡不移動,則改變的條件可能是在恒壓條件下充入一定量的CO2氣體,故答案為:在恒壓條件下充入一定量的CO2氣體;
(4)由(2)知,T1時,反應③的平衡常數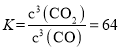 ,因為T1>T2>T3,所以T2、T3時,反應達到平衡后K3>K2>K,則達到平衡后,T3時的
,因為T1>T2>T3,所以T2、T3時,反應達到平衡后K3>K2>K,則達到平衡后,T3時的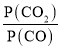 >T2時的
>T2時的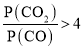 ,故曲線a表示T2時P(CO2)隨時間變化的關系曲線,曲線d表示T2時P(CO)隨時間變化的關系曲線,曲線b表示T3時P(CO2)隨時間變化的關系曲線,曲線c表示T3時P(CO)隨時間變化的關系曲線,由于溫度不變,平衡常數不變,故向T3時已經達到平衡狀態的反應③體系中再充入一定量的CO,再次達到平衡時,CO與CO2的物質的量之比仍為1:7,故答案為:a;c;1:7。
,故曲線a表示T2時P(CO2)隨時間變化的關系曲線,曲線d表示T2時P(CO)隨時間變化的關系曲線,曲線b表示T3時P(CO2)隨時間變化的關系曲線,曲線c表示T3時P(CO)隨時間變化的關系曲線,由于溫度不變,平衡常數不變,故向T3時已經達到平衡狀態的反應③體系中再充入一定量的CO,再次達到平衡時,CO與CO2的物質的量之比仍為1:7,故答案為:a;c;1:7。


 備戰中考寒假系列答案
備戰中考寒假系列答案科目:高中化學 來源: 題型:
【題目】CoC2O4是制備金屬鈷的原料。利用含鈷廢料(主要成分為Co2O3,含少量Fe2O3、Al2O3、CaO、MgO、碳及有機物等)制取CoC2O4的工藝流程如圖:
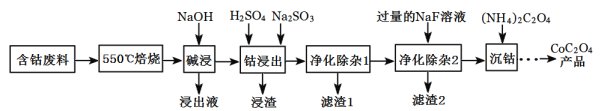
(1)“550℃煅燒”的目的是_______。
(2)“浸出液”的主要成分是_______。
(3)“鈷浸出”過程中Co3+轉化為Co2+,反應的離子方程式為_________。
(4)“凈化除雜1”過程中,需在40~50℃加入H2O2溶液,其目的是______。(用離子方程式表示);再升溫至80~85℃,加入Na2CO3溶液,調pH至5,“濾渣I”的主要成分是______。
(5)“凈化除雜2”可將鈣、鎂離子轉化為沉淀過濾除去,若所得濾液中c(Ca2+)=1.0×l0-5mol/L,則濾液中c(Mg2+)為___[已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10]
(6)為測定制得的CoC2O4產品的純度,現稱取1.000g樣品,將其用適當試劑轉化為草酸銨[(NH4)2C2O4]溶液,再用過量稀硫酸酸化,用0.1000mol/L高錳酸鉀溶液滴定,達到滴定終點,共用去高錳酸鉀溶液26.00mL,該產品的純度為_______________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】I2在KI溶液中存在平衡:I2(aq)+I-(aq)![]() I3-(aq),某I2、KI混合溶液中,c(I3-)與溫度T的平衡曲線圖如圖。下列說法不正確的是
I3-(aq),某I2、KI混合溶液中,c(I3-)與溫度T的平衡曲線圖如圖。下列說法不正確的是
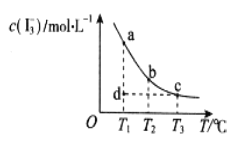
A.反應I2(aq)+I-(aq)![]() I3-(aq)的△H>0
I3-(aq)的△H>0
B.若溫度為T1、T2,反應的平衡常數分別為K1、K2,則K1>K2
C.若反應進行到狀態d時,一定有![]() 正>
正>![]() 逆
逆
D.狀態a與狀態b相比,狀態a的c(I2)小
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】硫酸亞鐵的用途廣泛,可以制備下圖所示物質,下列說法錯誤的是( )
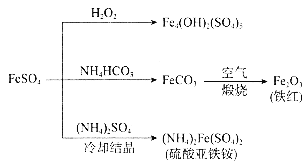
A.![]() 屬于堿式鹽,可用作凈水劑
屬于堿式鹽,可用作凈水劑
B.與足量![]() 反應的離子方程式為:
反應的離子方程式為:![]()
C.可用稀硫酸和![]() 溶液檢驗鐵紅中是否含有
溶液檢驗鐵紅中是否含有![]()
D.“冷卻結晶”后的操作是過濾,“煅燒”操作的主要儀器有酒精燈、蒸發皿、玻璃棒
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在恒壓、NO和O2的起始濃度一定的條件下,催化反應相同時間,測得不同溫度下NO轉化為NO2的轉化率如圖中實線所示(圖中虛線表示相同條件下NO的平衡轉化率隨溫度的變化)。下列說法不正確的是( )
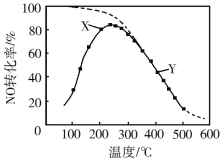
A.反應2NO(g)+O2(g)=2NO2(g)的ΔH<0
B.圖中X點所示條件下,延長反應時間能提高NO轉化率
C.圖中Y點所示條件下,增加O2的濃度不能提高NO轉化率
D.380℃下,c起始(O2)=5.0×104mol·L1,NO平衡轉化率為50%,則平衡常數K>2000
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖所示是金剛石的晶胞結構,除頂點和面心上有碳原子外,4條體對角線的1/4處還各有1個碳原子。回答下列問題:

(1)若圖中原子1的坐標為![]() ,則原子2的坐標為________。若金剛石的晶胞參數為
,則原子2的坐標為________。若金剛石的晶胞參數為![]() ,則其中碳碳鍵的鍵長
,則其中碳碳鍵的鍵長![]() ________pm(用含
________pm(用含![]() 的代數式表示)。
的代數式表示)。
(2)面心立方![]() 晶胞與金剛石結構類似,陰、陽離子各占晶胞所含微粒數的一半。
晶胞與金剛石結構類似,陰、陽離子各占晶胞所含微粒數的一半。
①S元素及其同周期的相鄰元素第一電離能由小到大的順序是________,二氯化硫(![]() )分子中S原子的雜化類型是________。
)分子中S原子的雜化類型是________。
②寫出基態![]() 的電子排布式________;把晶胞示意圖中表示
的電子排布式________;把晶胞示意圖中表示![]() 的小球全部涂黑_______。
的小球全部涂黑_______。
③鋅錳干電池中![]() 可吸收電池反應產生的
可吸收電池反應產生的![]() 生成
生成![]() ,該離子中含有________個
,該離子中含有________個![]() 鍵。
鍵。
④若該![]() 晶胞的晶胞參數為
晶胞的晶胞參數為![]() ,阿伏加德羅常數的值為
,阿伏加德羅常數的值為![]() ,則晶體的密度為________
,則晶體的密度為________![]() (列出計算式)
(列出計算式)
(3)有人設想冰的晶胞也應該類似于金剛石,但實際較為復雜,可能是因為氫鍵較弱而導致“飽和性和方向性”很難被嚴格執行。例如有文獻報道氨晶體中每個氫原子都形成氫鍵,則每個![]() 與周圍________個
與周圍________個![]() 通過氫鍵相結合。
通過氫鍵相結合。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一定溫度時,向2.0 L恒容密閉容器中充入2 mol SO2和1 mol O2,發生反應:2SO2(g)+O2(g)![]() 2SO3(g)。經過一段時間后達到平衡。反應過程中測定的部分數據見下表:
2SO3(g)。經過一段時間后達到平衡。反應過程中測定的部分數據見下表:
t / s | 0 | 2 | 4 | 6 | 8 |
n(SO3) / mol | 0 | 0.8 | 1.4 | 1.8 | 1.8 |
下列說法正確的是( )
A. 反應在前2 s 的平均速率v(O2) = 0.4 mol·L-1·s-1
B. 保持其他條件不變,體積壓縮到1.0 L,平衡常數將增大
C. 相同溫度下,起始時向容器中充入4 mol SO3,達到平衡時,SO3的轉化率小于10%
D. 保持溫度不變,向該容器中再充入2 mol SO2、1 mol O2,反應達到新平衡時n(SO3)/n(O2)減小
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】A、B、C、D、E、F、G均為短周期元素,原子序數依次遞增。A元素原子核內無中子,B元素原子最外層電子數是次外層電子數的2倍,D是地殼中含量最多的元素,E是短周期中金屬性最強的元素,F與G位置相鄰,G是同周期元素中原子半徑最小的主族元素。請回答下列問題:
(1)C在元素周期表中的位置為___,G的原子結構示意圖是___。
(2)D與E按原子個數比1:1形成化合物甲,其電子式為___,所含化學鍵類型為___。向甲中滴加足量水時發生反應的化學方程式是___。
(3)E、F、G三種元素所形成的簡單離子,半徑由大到小的順序是___。(用離子符號表示)
(4)用BA4、D2和EDA的水溶液組成燃料電池,電極材料為多孔惰性金屬電極。在a極通入BA4氣體,b極通入D2氣體,則a極是該電池的___極,負極的電極反應式為___。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】HI常用作有機反應中的還原劑,受熱會發生分解反應。已知![]() 時:
時:![]() ,向1L密閉容器中充入1molHI,
,向1L密閉容器中充入1molHI,![]() 時,體系中
時,體系中![]() 與反應時間t的關系如圖所示。下列說法中,正確的是
與反應時間t的關系如圖所示。下列說法中,正確的是

A.![]() min內的平均反應速率可表示為
min內的平均反應速率可表示為![]()
![]()
B.升高溫度,再次平衡時,![]()
![]()
C.該反應的化學平衡常數計算式為![]()
D.反應進行40min時,體系吸收的熱量約為![]() kJ
kJ
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com