
科目:高中化學 來源: 題型:
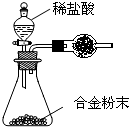 A-F六種元素中,除A外均為短周期元素,它們的原子結構或性質如表所示:
A-F六種元素中,除A外均為短周期元素,它們的原子結構或性質如表所示:| 序號 | 元素 | 結構或性質 | ||
| ① | A | 生活中常見的金屬,它有兩種氯化物,相對分子質量相差35.5 | ||
| ② | B | 原子最外層電子數是內層電子數的
| ||
| ③ | C | 形成化合物種類最多的元素之一,其單質為固體 | ||
| ④ | D | 地殼中含量最多的元素 | ||
| ⑤ | E | 與D同主族 | ||
| ⑥ | F | 與E同周期,且最外層電子數等于電子層數 |
查看答案和解析>>
科目:高中化學 來源:2011屆河南省鄭州外國語高三上學期第二次月考(理綜)化學部分 題型:實驗題
A—F六種元素中,除C外其他均為短周期元素,它們的原子結構或性質如下表所示:
| 元素 | 結構或性質 |
| A | 原子最外層電子數是內層電子總數的1/5 |
| B | 形成化合物種類最多的元素,其單質為固體 |
| C | 生活中常見的金屬,它有兩種常見的氯化物,且相對分子質量相差35.5 |
| D | 地殼中含量最多的元素 |
| E | 與D同主族 |
| F | 與E同周期,且最外層電子數等于電子層數 |
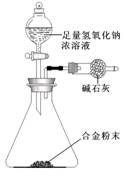
查看答案和解析>>
科目:高中化學 來源:2013-2014學年上海市閘北區高三上學期期末考試化學試卷(解析版) 題型:填空題
硫鐵礦又稱黃鐵礦(主要成分FeS2,雜質不含硫元素),是地殼中分布最廣的硫化物。因其淺黃的顏色和明亮的金屬光澤,常被誤認為是黃金,故又稱“愚人金”。
工業上硫鐵礦主要用于接觸法制造硫酸,其反應原理為:
①FeS2與O2高溫下反應生成SO2;
②SO2在催化劑作用下與O2反應生成SO3;
③SO3與H2O反應生成H2SO4.
(1)若1.00噸 SO2與O2的混合氣體中含SO2 0.40噸,在一定條件下發生反應②,有80%的SO2發生轉化,則反應后混合氣體中SO3的質量分數是_________。
(2)現用80噸硫鐵礦制硫酸,最后生產出100噸98%的硫酸。若反應過程中硫元素的損失率為5%,則硫鐵礦中FeS2的質量分數為__________________。
(3)在濃硫酸中繼續溶解SO3后所形成的液體稱發煙硫酸,其濃度通常以游離的SO3含量來表示,如20%的發煙硫酸即表示在硫酸中含有20%的SO3。現有1L含SO330%的發煙硫酸(密度為1.95g/cm3),要把它稀釋成質量分數為95%的濃硫酸,需加水約多少?(寫出計算過程)
(4)已知:850℃~900℃時,硫鐵礦在氧氣中煅燒,可能發生下列反應:
①3FeS2+8O2→Fe3O4+6SO2
②4FeS2+11O2→2Fe2O3+8SO2
為使FeS2煅燒完全生成Fe2O3,工業上使用過量氧氣,當氧氣過量20%時,求所得爐氣中SO2的體積分數。(寫出計算過程)
57.將480 g純凈的FeS2在氧氣中完全反應,若所得固體中n(Fe)∶n(O)=4∶a,此時消耗氧氣b mol,試寫出b與a的關系式_______________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com