
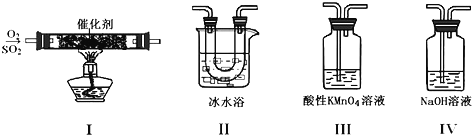
【題目】利用如圖所示的裝置研究SO2的性質:
已知:
物質 | 熔點℃ | 沸點℃ |
SO2 | -76.1 | -10 |
SO3 | 16.8 | 45 |
(1)裝置Ⅰ模擬工業生產中SO2催化氧化的反應,其化學方程式________________。
(2)甲同學按Ⅰ、Ⅱ、Ⅲ、Ⅳ的順序連接裝置,裝置Ⅱ的作用是___;觀察到裝置Ⅲ中現象是________________,說明二氧化硫具有___性
(3)乙同學按Ⅰ、Ⅱ、Ⅳ的順序連接裝置(裝置Ⅱ中充分冷卻),若裝置Ⅳ中有40mL2.5mol/LNaOH溶液,反應后增重4.8g,則裝置Ⅳ中發生反應的總的化學方程式是___
【答案】2SO2+O2![]() 2SO3 使SO3凝結成固體與SO2分離 溶液顏色褪去(或變淺) 還原 4NaOH+3SO2=Na2SO3+2NaHSO3+H2O
2SO3 使SO3凝結成固體與SO2分離 溶液顏色褪去(或變淺) 還原 4NaOH+3SO2=Na2SO3+2NaHSO3+H2O
【解析】
裝置Ⅰ中,發生反應2SO2+O2![]() 2SO3,由于反應可逆,生成的SO3中混有SO2和O2;裝置Ⅱ中,冰水浴使混合氣中的SO3凝結成固體;裝置Ⅲ中,SO2被酸性KMnO4溶液吸收,從而使酸性KMnO4溶液褪色;裝置Ⅳ用于吸收尾氣,將SO2轉化為Na2SO3或NaHSO3或二者的混合物。
2SO3,由于反應可逆,生成的SO3中混有SO2和O2;裝置Ⅱ中,冰水浴使混合氣中的SO3凝結成固體;裝置Ⅲ中,SO2被酸性KMnO4溶液吸收,從而使酸性KMnO4溶液褪色;裝置Ⅳ用于吸收尾氣,將SO2轉化為Na2SO3或NaHSO3或二者的混合物。
(1)由以上分析可知,裝置 Ⅰ 模擬工業生產中SO2催化氧化的反應,其化學方程式為2SO2+O2![]() 2SO3。答案為:2SO2+O2
2SO3。答案為:2SO2+O2![]() 2SO3;
2SO3;
(2)由以上分析知,裝置Ⅱ的作用是使SO3凝結成固體與SO2分離;裝置Ⅲ中發生反應:5SO2+2KMnO4+2H2O==K2SO4+2MnSO4+2H2SO4,觀察到現象是溶液顏色褪去(或變淺),說明二氧化硫具有還原性。答案為:使SO3凝結成固體與SO2分離;溶液顏色褪去(或變淺);還原;
(3)n(NaOH)=0.040L×2.5mol/L=0.1mol,n(SO2)=![]() =0.075mol,n(NaOH):n(SO2)== 0.1mol:0.075mol=4:3,則裝置Ⅳ中發生反應的總的化學方程式是4NaOH+3SO2==Na2SO3+2NaHSO3+H2O。答案為:4NaOH+3SO2==Na2SO3+2NaHSO3+H2O。
=0.075mol,n(NaOH):n(SO2)== 0.1mol:0.075mol=4:3,則裝置Ⅳ中發生反應的總的化學方程式是4NaOH+3SO2==Na2SO3+2NaHSO3+H2O。答案為:4NaOH+3SO2==Na2SO3+2NaHSO3+H2O。


科目:高中化學 來源: 題型:
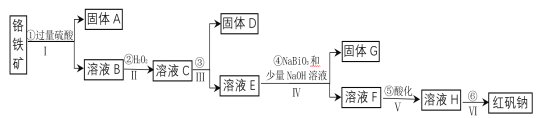
【題目】工業上以鉻鐵礦(主要成分為FeO和Cr2O3,含有Al2O3、SiO2等雜質)為主要原料生產化工原料紅礬鈉(主要成分為:Na2Cr2O7·2H2O),其主要工藝流程如下:
查閱相關資料得知:
i.常溫下,NaBiO3不溶于水,有強氧化性,在堿性條件下能將Cr3+轉化為CrO42—,自身被還原為Bi(OH)3固體。
ii.
物質 | Fe(OH)3 | Al(OH)3 | Cr(OH)3 | Fe(OH)2 | Bi(OH)3 |
開始沉淀的PH | 2.7 | 3.4 | 4.6 | 7.5 | 0.7 |
完全沉淀的PH | 3.7 | 4.4 | 5.9 | 9.7 | 4.5 |
回答下列問題:
(1)將鉻鐵礦礦石粉碎的目的是___________。
(2)操作I、III、IV用到的主要玻璃儀器有玻璃棒和___________(填儀器名稱)。
(3)寫出④反應的化學方程式________________。
(4)⑤中酸化是使CrO42—轉化為Cr2O72—。寫出該反應的離子方程式______。
(5)將溶液H經下列操作:蒸發濃縮,__________,過濾,洗滌,干燥即得紅礬鈉。
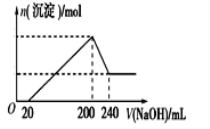
(6)取一定質量的固體D溶解于200mL的稀硫酸中,向所得溶液中加入5.0mol/L的NaOH溶液,生成沉淀的物質的量(n)與加入NaOH溶液的體積(V)關系如圖所示,則稀硫酸的濃度為_________,固體D中含Fe化合物的物質的量為___________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】西安北郊古墓中曾出土一青銅錘(一種酒具),表面附著有綠色固體物質,打開蓋子酒香撲鼻,內盛有26 kg青綠色液體,專家認定是2000多年前的“西漢美酒”。這是我國考古界、釀酒界的一個重大發現。
(1)上述報道引發了某校化學興趣小組同學的關注,他們收集家中銅器表面的綠色固體進行探究。
提出問題:銅器表面附著綠色固體物質是由哪些元素組成的?
猜想:查閱相關資料后,猜想綠色固體物質可能是銅綠。
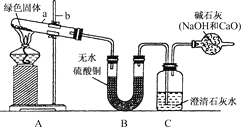
實驗步驟:
①對試管內的綠色固體進行加熱,至完全分解.觀察到A裝置中綠色固體逐漸變成黑色,B裝置中無水硫酸銅變成藍色,C裝置中澄清石灰水變渾濁.
②取少量加熱后生成的黑色固體于試管中,加入稀硫酸.觀察到黑色固體逐漸溶解,溶液變成藍色。
③取少量上述藍色溶液于試管中,浸入一根潔凈的鐵絲.觀察到鐵絲表面有紅色物質析出。
④實驗結論:綠色固體物質中含有________、________、________、________等元素。(提示:裝置內的空氣因素忽略不計)
(2)表達與交流:①圖中標有a、b的儀器名稱是:a:________;b:________。
②上述實驗步驟③中發生反應的離子方程式為____________________________。
③反應完成后,如果先移去酒精燈,可能出現的現象是______________________。
④如果將B、C兩裝置對調行嗎?____。為什么?______________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】祖母綠的主要成分為Be3Al2Si6Ol8,含有O、Si、Al、Be等元素。請回答下列問題:
(1)基態A1原子中,電子占據的最高能級的符號是_______________________,該能級具有的原子軌道數為_______。
(2)在1000℃時,氯化鈹以BeCl2形式存在,其中Be原子的雜化方式為_________;在500600℃氣相中,氯化鈹則以二聚體Be2Cl4的形式存在,畫出Be2Cl4的結構____________,1molBe2Cl4中含有____mol配位鍵。
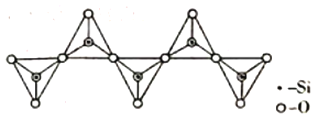
(3)氫化鋁鋰(LiAlH4)是有機合成中一種重要的還原劑,LiAlH4的陰離子的空間構型為____________,該陰離子的等電子體為____________(寫一種分子、一種離子)。一種無限長單鏈結構的多硅酸根的一部分如圖所示,則該硅酸根的化學式為____________________。
(4)用氧化物的形式表示出祖母綠的組成:___________。如圖是Be與O形成的氧化物的立方晶胞結構,已知氧化鈹的密度為ρg/cm3,則晶胞邊長為__________cm。(設NA為阿伏加德羅常數的值,用含ρ、NA的代數式表示),O2-的配位數為_____________。

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】空間實驗室“天宮一號”的供電系統中有再生氫氧燃料電池(RFC),RFC是一種將水電解技術與氫氧燃料電池技術相結合的可充電電池。下圖為RFC工作原理示意圖,有關說法正確的是
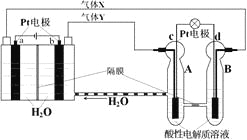
A. 轉移0.1mol電子時,a電極產生標準狀況下O2 1.12L
B. b電極上發生的電極反應是:2H2O+2e-=H2↑+2OH-
C. c電極上進行還原反應,B池中的H+可以通過隔膜進入A池
D. d電極上發生的電極反應是:O2+4H++4e-=2H2O
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】幾種晶體的晶胞如圖所示:
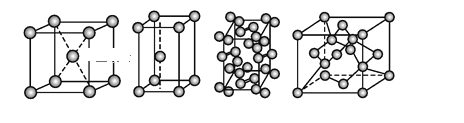
所示晶胞從左到右分別表示的物質正確的排序是
A. 碘、鋅、鈉、金剛石B. 金剛石、鋅、碘、鈉
C. 鈉、鋅、碘、金剛石D. 鋅、鈉、碘、金剛石
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】碳及其化合物廣泛存在于自然界中。回答下列問題:
(1)在基態14C原子中,核外存在______對自旋相反的電子。
(2)碳在形成化合物時,其鍵型以共價鍵為主,原因是__________。
(3)CS2分子中,共價鍵的類型有________,C原子的雜化軌道類型是______,寫出兩個與CS2具有相同空間構型和鍵合形式的分子或離子_______。
(4)碳有多種同素異形體,其中石墨烯與金剛石的晶體結構如圖所示:
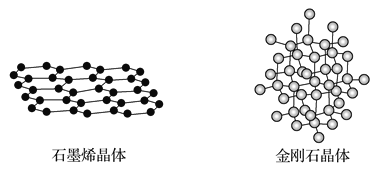
①在石墨烯晶體中,每個C原子連接_____個六元環,每個六元環占有___個C原子。
②在金剛石晶體中,C原子所連接的最小環也為六元環,每個C原子連接_____個六元環,六元環中最多有______個C原子在同一平面。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一種有機玻璃的結構簡式為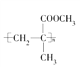 。下列關于它的敘述中不正確的是( )
。下列關于它的敘述中不正確的是( )
A. ![]() 在一定條件下發生縮聚反應即可合成該有機玻璃
在一定條件下發生縮聚反應即可合成該有機玻璃
B. 該有機玻璃能發生氧化反應
C. 合成該有機玻璃的原料可能有甲烷
D. 它在一定條件下發生水解反應時C—O鍵斷裂
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】H2S是一種劇毒氣體,對H2S廢氣資源化利用的途徑之一是回收能量并得到單質硫。如圖為質子膜H2S燃料電池的示意圖。下列說法正確的是( )
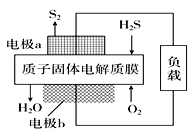
A. 電極a發生還原反應
B. 當電路中通過4 mol電子時,有4molH+經質子膜進入負極區
C. 電池總反應為:2H2S+3O2 =2SO2+2H2O
D. 電極b的電極反應式為:O2+4e-+4H+=2H2O
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com