
【題目】關于下圖的說法不正確的是( )
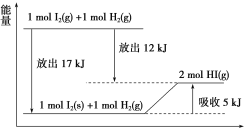
A.1 mol I2(s)與1 mol H2(g)化合生成2 mol HI(g)時,需要吸收5 kJ的能量
B.2 mol HI(g)分解生成1 mol I2(g)與1 mol H2(g)時,需要吸收12 kJ的能量
C.1 mol I2(s)變為1 mol I2(g)時需要吸收17 kJ的能量
D.I2(g)與H2(g)生成2HI(g)的反應是吸熱反應
【答案】D
【解析】
A.由圖可知,1 mol I2(s)和1 mol H2(g)吸收5 kJ熱量生成2 mol HI(g),A正確;
B.由圖可知,1 mol I2(g)和1 mol H2(g)生成2 mol HI(g)放出12 kJ熱量,則2 mol HI(g)分解生成1 mol I(g)與1 mol H2(g)時需要吸收12 kJ的能量,B正確;
C.由圖可知,1 mol I2(g)變為1 mol I2(s)放出17 kJ的熱量,則1 mol固態碘變為1 mol碘蒸氣時需要吸收17 kJ的能量,C正確;
D.由圖可知,1 mol I2(g)+1 mol H2(g)生成2 mol HI(g)放出12 kJ熱量,應為放熱反應,D錯誤。
答案為D。


科目:高中化學 來源: 題型:
【題目】海水中蘊藏著豐富的資源,某學習小組在實驗室模擬從海水提取氯化鈉晶體,其實驗流程如下:

通過查閱資料可知:粗鹽中含有CaCl2、MgCl2、Na2SO4等雜質。該學習小組通過討論,設計實驗在從粗鹽精制得到食鹽水的過程為:
①取一定量的粗鹽溶解;
②向粗鹽水中依次加入過量的Na2CO3溶液、加入過量的NaOH、加入過量的BaCl2溶液;
③過濾;
④向濾液中加入適量鹽酸。
回答:
(1)溶解時需要的儀器有________。
(2)加入過量的Na2CO3溶液時觀察到的現象是________;反應的化學方程式為_______________________________。
(3)實驗后,通過進一步反復論證,向老師求證,發現在粗鹽精制得到食鹽水的設計方案中________(“有”或“沒有”)不妥之處,理由是______________________。
(4)該學習小組同學要從食鹽水得到氯化鈉晶體時,還要進行________、______、過濾。
(5)該學習小組同學用實驗得到的晶體配制1mol·L-1的NaCl溶液500mL,在配制過程中,下列操作會引起濃度偏高的是________。
①沒有洗滌燒杯和玻璃棒
②容量瓶不干燥,含有少量蒸餾水
③定容時仰視刻度線
④定容時俯視刻度線
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】從香莢蘭豆中提取的一種芳香化合物,其分子式為C8H8O3,遇FeCl3溶液會呈現特征顏色,能發生銀鏡反應。該化合物可能的結構簡式是( )
A.  B.
B.  C.
C.  D.
D. 
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)在配合物Fe(SCN)2+中,提供空軌道接受孤對電子的微粒是__,畫出配合物離子[Cu(NH3)4]2+中的配位鍵__.
(2)根據VSEPR模型,H3O+的分子立體結構為__,BCl3的立體結構為__.
(3)按要求寫出由第二周期元素為中心原子,通過sp3雜化形成中性分子的化學式(各寫一種)
正四面體分子__,三角錐形分子__,V形分子______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知:4NH3+5O2==4NO+6H2O,若反應速率分別用v(NH3)、v(O2)、v(NO)、v(H2O)表示,單位都為mol/(Ls),則正確的關系是
A. ![]() B.
B. ![]()
C. ![]() D.
D. ![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】結合元素周期表,完成下列問題。

(1)在元素周期表中全部是金屬元素的區域為_____________。
a.A b.B c.C d.D
(2)I和II元素形成的化合物的化學式為_____,一定含有____鍵。
(3)現有甲、乙兩種短周期元素,室溫下,甲元素的單質在冷的濃硫酸或空氣中表面都會生成致密的氧化膜,乙元素原子核外第三層與第一層上的電子數相等。
①將甲、乙兩元素的元素符號填寫在上面元素周期表中對應的位置__并寫出甲單質與NaOH溶液反應的離子方程式____。
②甲、乙兩元素中,金屬性較強的是_____(填元素名稱),可以驗證該結論的實驗是____(填序號)。
a.將在空氣中放置已久的這兩種元素的單質分別放入熱水中
b.將這兩種元素的單質粉末分別和相同濃度的鹽酸反應
c.將這兩種元素的單質粉末分別和熱水作用,并滴入酚酞溶液
d.比較這兩種元素的氣態氫化物的穩定性
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】Ⅰ、(1)某種金屬互化物具有自范性,原子在三維空間里呈周期性有序排列,該金屬互化物屬于__________(填 “晶體”或“非晶體”),可通過__________方法鑒別。
(2)基態Ni2+的核外電子排布式為__________;配合物Ni(CO)4常溫下為液態,易溶于CCl4、苯等有機溶劑。固態Ni(CO)4屬于__________晶體;Ni2+和Fe2+的半徑分別為69pm和78pm,則熔點NiO__________FeO(填“<”或“>”)。
Ⅱ、判斷含氧酸強弱的一條經驗規律是:含氧酸分子結構中含非羥基氧原子數越多,該含氧酸的酸性越強。如下表所示
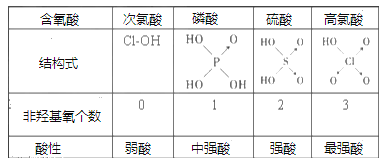
(1)亞磷酸(H3PO3)和亞砷酸(H3AsO3)分子式相似,但它們的酸性差別很大,H3PO3是中強酸,H3AsO3只有弱酸性。由此可推出亞磷酸的結構式為___________。從分子結構角度,簡述二者酸性強弱原因_____________________。
(2)亞磷酸與過量的氫氧化鈉溶液反應的化學方程式為:________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】工業上以釩爐渣(主要含V2O3,還有少量SiO2、P2O5等雜質)為原料可以制備氧釩堿式碳酸銨晶體[(NH4)5(VO)6(CO3)4(OH)9·10H2O],其生產工藝流程如下。
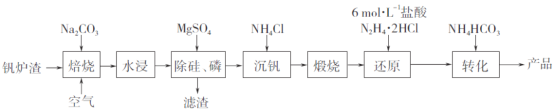
(1)焙燒過程中V2O3轉化為可溶性NaVO3,該反應的化學方程式為_________________________________。
(2)濾渣的主要成分是________________(寫化學式)。
(3)“沉釩”得到偏釩酸銨(NH4VO3),若濾液中c(VO3-)=0.1mol·L-1,為使釩元素的沉降率達到98%,至少應調節c(NH4+)為____mol·L-1。[已知Ksp(NH4VO3)=1.6×10-3]
(4)“還原”V2O5過程中,生成VOC12和一種無色無污染的氣體,該反應的化學方程式為_______________________。用濃鹽酸與V2O5反應也可以制得VOC12,該方法的缺點是____________________________。
(5)稱量a g產品于錐形瓶中,用20mL蒸餾水與30mL稀硫酸溶解后,加入0.02mol·L-1KMnO4溶液至稍過量,充分反應后繼續滴加1%的NaNO2溶液至稍過量,再用尿素除去過量NaNO2,最后用c mol·L-1(NH4)2Fe(SO4)2標準溶液滴定至終點,消耗標準溶液的體積為b mL。(已知滴定反應為VO2++Fe2++2H+==VO2++Fe3++H2O)
①KMnO4溶液的作用是______________。
②粗產品中釩的質量分數表達式為________(以VO2計)。
③若(NH4)2Fe(SO4)2標準溶液部分變質,會使測定結果_____(填“偏高”、“偏低”或“無影響”)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知可逆反應X(g)+2Y(g)![]() Z(g) ΔH <0,一定溫度下,在體積為2 L的密閉容器中加入4 mol Y和一定量的X后,X的濃度隨時間的變化情況如圖所示,則下列說法正確的是( )
Z(g) ΔH <0,一定溫度下,在體積為2 L的密閉容器中加入4 mol Y和一定量的X后,X的濃度隨時間的變化情況如圖所示,則下列說法正確的是( )

A. 若向該容器中加入1molX、2molY,達平衡時,X的平衡濃度小于0.125mol/L
B. a點正反應速率大于逆反應速率
C. 反應達平衡時,降低溫度可以實現c到d的轉化
D. 該條件下,反應達平衡時,平衡常數K=3
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com