
【題目】將一定量的銅粉加入到0.5 L 0.3 mol·L-1 Fe2(SO4)3和0.1 mol·L-1 H2SO4的混合溶液中,銅粉完全溶解后,得到溶液X。下列說法正確的是 ( )
A. 溶液X中Cu2+與Fe2+的物質的量之比為2∶1
B. 向溶液X中加入足量鐵粉,充分反應后,鐵粉質量減少11.2 g
C. 向溶液X中滴加KSCN溶液,未變紅色,則加入銅粉質量為12.8 g
D. 向溶液X中加入0.18 L 5 mol·L-1 NaOH溶液可使溶液中的金屬離子完全沉淀
【答案】B
【解析】A、加入銅粉時只發生反應Cu+2Fe3+=Cu2++2Fe2+,根據反應可知,溶液X中Cu2+與Fe2+的物質的量之比為1∶2,選項A錯誤;B、根據氧化還原反應原理可知,消耗鐵粉的量只可以直接按原溶液中鐵離子和氫離子計算2Fe3++Fe=3Fe2+、2H++Fe=Fe2++H2↑,則鐵粉質量減少(0.5 L![]() 0.3 mol·L-1 +0.5 L
0.3 mol·L-1 +0.5 L![]() 0.1 mol·L-1)
0.1 mol·L-1)![]() =11.2g,選項B正確;C、向溶液X中滴加KSCN溶液,未變紅色,則Fe3+剛好反應完,根據反應Cu+2Fe3+=Cu2++2Fe2+可知,加入銅粉質量為0.5 L
=11.2g,選項B正確;C、向溶液X中滴加KSCN溶液,未變紅色,則Fe3+剛好反應完,根據反應Cu+2Fe3+=Cu2++2Fe2+可知,加入銅粉質量為0.5 L![]() 0.3 mol·L-1
0.3 mol·L-1 ![]() =9.6g,選項C錯誤;D、根據反應原理,加入氫氧化鈉溶液反應后除產生沉淀外,所得溶液應為硫酸鈉溶液,則根據鈉原子和硫原子守恒,原溶液中含有的硫酸根的物質的量為0.5 mol,則向溶液X中加入0.2 L 5 mol·L-1 NaOH溶液可使溶液中的金屬離子完全沉淀,選項D錯誤。答案選B。
=9.6g,選項C錯誤;D、根據反應原理,加入氫氧化鈉溶液反應后除產生沉淀外,所得溶液應為硫酸鈉溶液,則根據鈉原子和硫原子守恒,原溶液中含有的硫酸根的物質的量為0.5 mol,則向溶液X中加入0.2 L 5 mol·L-1 NaOH溶液可使溶液中的金屬離子完全沉淀,選項D錯誤。答案選B。


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
【題目】含硫化合物在生產生活中應用廣泛,科學使用對人體健康及環境保護意義重大。
(1)紅酒中添加一定量的SO2 可以防止酒液氧化,這應用了SO2 的___性。
(2)某水體中硫元素主要以S2O32-形式存在,在酸性條件下,該離子會導致水體中有黃色渾濁并可能有刺激性氣味產生,原因是___________________________________。(用離子方程式說明)
(3)實驗室采用滴定法測定某水樣中亞硫酸鹽含量:
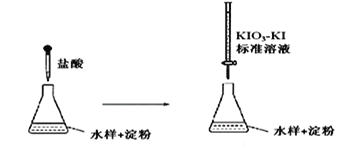
滴定時,KIO3 和KI 在鹽酸作用下析出I2:5I-+ IO3- + 6H+ =3I2+3H2O
生成的I2 再和水樣中的亞硫酸鹽反應:I2 + SO32- + H2O = 2H++2I-+ SO42-
①滴定到終點時的現象是:________________________________
②若滴定前盛標準液的滴定管沒有用標準液潤洗,則測定結果將_________(填“偏大、偏小、不變”)。
③滴定終點時,100mL的水樣共消耗x mL標準溶液。若消耗1mL標準溶液相當于SO32-的質量1g,則該水樣中SO32-的含量為__________g / L
(4)已知非金屬單質硫(S)是淡黃色固體粉末,難溶于水.為了驗證氯元素的非金屬性比硫元素的非金屬性強,某化學實驗小組設計了如下實驗,請回答下列問題:
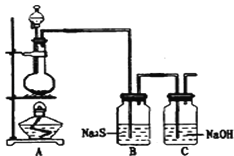
①若裝置A的圓底燒瓶中盛裝二氧化錳,則分液漏斗中盛裝的試劑是_____________________
②裝置B中實驗現象為___________________________,證明氯元素的非金屬性比硫元素的非金屬性強。
③裝置C中反應的作用是:____________________________
查看答案和解析>>
科目:高中化學 來源: 題型:
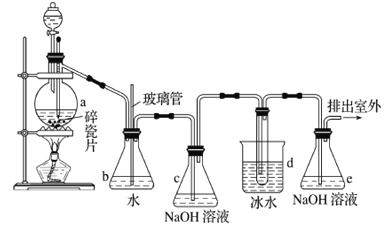
【題目】1,2-二溴乙烷可作抗爆劑的添加劑。如圖為實驗室制備1,2-二溴乙烷的裝罝圖, 圖中分液漏斗和燒瓶a中分別裝有濃H2SO4和無水乙醇,d裝罝試管中裝有液溴。
已知:CH3CH2OH![]() CH2=CH2↑+H2O;2CH3CH2OH
CH2=CH2↑+H2O;2CH3CH2OH![]() CH3CH2OCH2CH3+H2O
CH3CH2OCH2CH3+H2O
相關數據列表如下:
乙醇 | 1,2-二溴乙烷 | 乙醚 | 溴 | |
狀態 | 無色液體 | 無色液體 | 無色液體 | 紅棕色液體 |
密度/g·cm-3 | 0.79 | 2.18 | 0.71 | 3.10 |
沸點/℃ | 78.5 | 131.4 | 34.6 | 58.8 |
熔點/℃ | -114.3 | 9.79 | - 116.2 | -7.2 |
水溶性 | 混溶 | 難溶 | 微溶 | 可溶 |
(1)實驗中應迅速將溫度升高到170℃左右的原因是______________________________。
(2)安全瓶b在實驗中有多重作用。其一可以檢查實驗進行中d裝罝中導管是否發生堵塞,請寫出發生堵塞時瓶b中的現象:_______________________________;如果實驗時d裝罝中導管堵塞,你認為可能的原因是_______________________________________________;安全瓶b還可以起到的作用是__________________。
(3)容器c、e中都盛有NaOH溶液,c中NaOH溶液的作用是________________________________。
(4)除去產物中少量未反應的Br2后,還含有的主要雜質為___________,要進一步提純,下列操作中必需的是_____________ (填字母)。
A.重結晶 B.過濾 C.蒸餾 D.萃取
(5)實驗中也可以撤去d裝罝中盛冰水的燒杯,改為將冷水直接加入到d裝罝的試管中,則此時冷水除了能起到冷卻1,2-二溴乙烷的作用外,還可以起到的作用是____________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】硫酰氯(SO2Cl2)常作氯化劑或氯磺化劑,用于制作藥品、染料、表面活性劑等。有關物質的部分性質如下表:
物質 | 熔點/℃ | 沸點/℃ | 其它性質 |
SO2Cl2 | -54.1 | 69.1 | ①易與水反應,產生大量白霧 ②易分解:SO2Cl2 |
H2SO4 | 10.4 | 338 | 吸水性且不易分解 |
實驗室用干燥而純凈的二氧化硫和氯氣合成硫酰氯,裝置如圖所示(夾持儀器已省略),請回答有關問題:
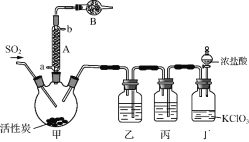
(1) 儀器A冷卻水的進口_______(填“a”或“b”)。
(2) 儀器B中盛放的藥品是_______。
(3) 實驗所需二氧化硫用亞硫酸鈉與硫酸制備,該反應的離子方程式為_______,以下與二氧化硫有關的說法中正確的是_______。
A.因為SO2具有漂白性,所以它能使品紅溶液、溴水、酸性KMnO4溶液、石蕊試液褪色
B.能使品紅溶液褪色的物質不一定是SO2
C.SO2、漂白粉、活性炭、Na2O2都能使紅墨水褪色,且原理相同
D.等物質的量的SO2和Cl2混合后通入裝有濕潤的有色布條的集氣瓶中,漂白效果更好
E.可用濃硫酸干燥SO2
F.可用澄清的石灰水鑒別SO2和CO2
(4) 裝置丙所盛試劑為_______,若缺少裝置乙,則硫酰氯會損失,該反應的化學方程為______________。
(5) 少量硫酰氯也可用氯磺酸(ClSO3H)分解獲得,該反應的化學方程式為:2ClSO3H===H2SO4+SO2Cl2,此方法得到的產品中會混有硫酸。
①從分解產物中分離出硫酰氯的方法是______________。
②請設計實驗方案檢驗產品中有硫酸(可選試劑:稀鹽酸、稀硝酸、BaCl2溶液、蒸餾水、石蕊溶液)____。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】捕集、利用CO2是人類可持續發展的重要戰略之一。
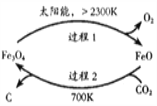
(1)用太陽能工藝捕獲CO2可得炭黑,其流程如圖所示:
①捕獲1molCO2轉移電子的物質的量是_________。
②過程2反應的化學方程式是__________。
(2)將CO2催化加氫可合成低碳烯烴:2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g)
C2H4(g)+4H2O(g)
按投料比n(CO2) : n(H2)=1:3將CO2與H2充入密閉容器,在0.1MPa時,測得平衡時四種氣態物質,其溫度(T)與物質的量(n)的關系如圖所示。
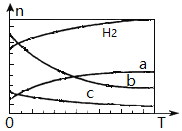
①正反應的焓變△H_______0 。
②提高CO2的轉化率,可采用的方法是_______。
A.減小n(CO2)與n(H2)的投料比
B.改變催化劑
C.縮小容器體積
③圖中表示乙烯的曲線是_______。
(3)以NH3與CO2為原料,合成尿素[化學式:CO(NH2)2]:
反應如下:①2NH3(g)+CO2(g)=NH2CO2NH4(s) △H=-159.5kJ/mol
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g) △H=+116.5kJ/mol
③H2O(l)=H2O(g) △H=+44.0kJ/mol
CO2與NH3形成液態水時,合成尿素的熱化學方程式是_______________;
(2)電解CO2可制得多種燃料:下圖是在酸性電解質溶液中,以惰性材料做電極,將CO2轉化為丙烯的原理模型。
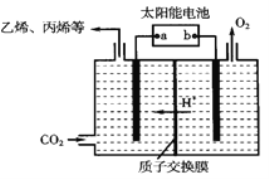
①太陽能電池的負極是_________。
②生成丙烯的電極反應式是__________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】工業上用苯和1,2—二氯乙烷制聯芐的反應原理如下
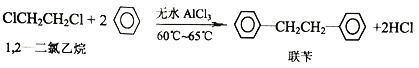
實驗室制取聯芐的裝置如圖所示(加熱和夾持儀器略去)
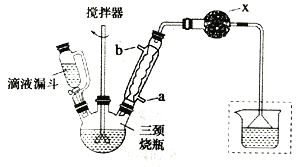
實驗步驟:
①在三頸燒瓶中加入120.0mL苯和適量無水AlCl3,由滴液漏斗滴加10.0mL 1,2-二氯乙烷,控制反應溫度在60~65℃,反應約60min。
②將反應后的混合物依次用2%Na2CO3溶液和水洗滌,在所得產物中加入少量無水MgSO4固體,靜置、過濾,蒸餾收集一定溫度下的餾分,得聯芐18.2g。
相關物理常數和物理性質如下表:
名稱 | 相對分子質量 | 密度/g·cm-3 | 熔點/℃ | 沸點/℃ | 溶解性 |
苯 | 78 | 0.88 | 5.5 | 80.1 | 難溶于水,易溶于乙醇 |
1,2-二氯乙烷 | 99 | 1.27 | -35.3 | 83.5 | 難溶于水,可溶于苯 |
聯芐 | 182 | 0.98 | 52 | 284 | 難溶于水,易溶于苯 |
(1)和普通分液漏斗相比,使用滴液漏斗的優點是_______________________;球形冷凝管進水口是____________(選填“a”或“b”)
(2)儀器X的名稱是________________;裝置中虛線部分的作用是____________。
(3)洗滌操作中,用2%Na2CO3溶液洗滌的目的是___________;水洗的目的是____________。
(4)在進行蒸餾操作時,應收集____________℃的餾分。
(5)該實驗中,聯芐的產率約為____________%(小數點后保留兩位)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】對水垢的主要成分是CaCO3和Mg(OH)2而不是CaCO3和MgCO3的解釋,說法正確的是
A. Mg(OH)2的溶度積大于MgCO3的溶度積,且在水中發生了沉淀轉化
B. Mg(OH)2比MgCO3更難溶,且在水中發生了沉淀轉化
C. MgCO3電離出的CO![]() 發生水解,使水中OH-濃度減小,對Mg(OH)2沉淀溶解平衡而言,Qc<Ksp,生成Mg(OH)2沉淀
發生水解,使水中OH-濃度減小,對Mg(OH)2沉淀溶解平衡而言,Qc<Ksp,生成Mg(OH)2沉淀
D. 二者不能相互轉化
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】4種相鄰主族短周期元素的相對位置如表,元素X的原子核外電子數是M的2倍,Y的氧化物具有兩性。回答下列問題:
![]()
(1)元素X在周期表中的位置是第________周期、第________族,其單質可采用電解熔融________的方法制備。
(2)M、N、Y三種元素最高價氧化物對應的水化物中,酸性最強的是____________,堿性最強的是______。(填化學式)
(3)氣體分子(MN)2的電子式為___________。(MN)2稱為擬鹵素,性質與鹵素類似,其與氫氧化鈉溶液反應的化學方程式為________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】25℃時,下圖燒杯中各盛有40 mL的溶液。

(1)甲溶液pH=__________,水電離的c(OH-)=________mol/L。
(2)若分別取20 mL甲溶液和乙溶液充分混合,所得的混合溶液丙的pH=6,水電離的c(H+)=________mol/L;溶液中離子濃度大小順序是__________。
(3)若將剩余的乙溶液全部倒入上述混合溶液丙中,所得的混合溶液pH>7,該溶液中離子濃度大小順序是___________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com