
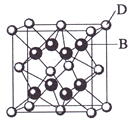
【題目】已知A、B、C、D和E都是元素周期表中前36號的元素,它們的原子序數依次增大。A與其他4種元素既不在同一周期又不在同一主族。B和C屬同一主族,D和E屬同一周期,又知E是周期表中1—18列中的第7列元素。D的原子序數比E小5,D跟B可形成離子化合物其晶胞結構如右圖。
請回答:
(1)A元素的名稱是 ;
(2)B的元素符號是 ,C的元素符號是 ,B與A形成的化合物比C 與A形成的化合物沸點高,其原因是
(3)E屬元素周期表中第 周期,第 族的元素,其元素名稱是 , 它的+2價離子的電子排布式為 :
(4)從圖中可以看出,D跟B形成的離子化合物的化學式為 ;該離子化合 物晶體的密度為ag·cm-3,則晶胞的體積是 (只要求列出算式)。
【答案】(1)氫 (2)F Cl 氟化氫分子間存在氫鍵,氯化氫分子間沒有氫鍵
(3)四 ⅦB 錳 1s22s22p63s23p63d5
(4)CaF2![]()
【解析】從D、E是周期表中1-18列中E排第7列可判斷E是第4周期VIIB族的Mn元素,原子序數為25,所以D也在第4周期,D的原子序數比E小5,則原子序數為20,應為Ca元素,圖中離子化合物D與B的離子個數比值為:(8×1/8+6×1/2):8=1:2,且D為Ca,則B的化合價為-1價,應為第ⅦA族元素,B和C屬同一主族,B的序數在前面,B為F,C為Cl;A與其他4種元素既不在同一周期又不在同一主族,所以A為H。
(1)A為H元素,名稱為氫;(2)B為F元素,C為Cl元素,HF中含有氫鍵,分子間的作用力較強,沸點較高;(3)E為Mn元素,位于周期表第四周期第七列,則應位于VIIB族,原子的核外電子的排布式為1s22s22p63s23p63d54s2,失去2個電子 ,離子的電子排布式為 1s22s22p63s23p63d5;(4)從圖中可以看出,晶胞中含有Ca的離子個數為8×1/8+6×1/2=4,含有F的離子個數為8,二者比值為1:2,則化學式為CaF2,晶胞中:ρ=m/V=  ,則V=
,則V=![]() 。
。


 百年學典課時學練測系列答案
百年學典課時學練測系列答案科目:高中化學 來源: 題型:
【題目】某中學化學興趣小組為了調查當地某一湖泊的水質污染情況,在注入湖泊的3個主要水源的入口處采集水樣,并進行了分析,給出了如下實驗信息:其中一處水源含有A、B兩種物質,一處含有C、D兩種物質,一處含有E物質,A、B、C、D、E為五種常見化合物,均由下表中的離子形成,其中C中有兩種陽離子:

為了鑒別上述化合物。分別完成以下實驗,其結果是:
①將它們溶于水后,D為藍色溶液,其他均為無色溶液;
②將E溶液滴入到C溶液中出現白色沉淀,繼續滴加,沉淀溶解;
③進行焰色反應,只有B、C為紫色(透過藍色鈷玻璃);
④在各溶液中加入硝酸鋇溶液,再加過量稀硝酸,A中放出無色氣體,C、D中都能產生白色沉淀;
⑤將B、D兩溶液混合,未見沉淀或氣體生成。
根據上述實驗填空:
(1)寫出C、D的化學式:C________,D________。
(2)將含1 mol A的溶液與含l mol E的溶液反應后蒸干,僅得到一種化合物,該化合物的化學式為___________。
(3)在A溶液中加入少量澄清石灰水,其離子方程式為_____________________________。
(4)若向含溶質l mol的C溶液中逐滴加入Ba(OH)2溶液,生成沉淀質量最大為_______g。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列實驗方法能達到目的是
A. 用焰色反應鑒別Na2CO3溶液和NaCl溶液
B. 用分液漏斗分離食醋中的乙酸與水
C. 用結晶的方法分離氯化鈉和硝酸鉀的混合物
D. 用NaOH溶液除去Cl2中混有的少量HCl
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】銅是重要金屬,Cu的化合物在科學研究和工業生產中具有許多用途,如CuSO4溶液常用作電解液、電鍍液等。請回答以下問題:
(1)CuSO4可由金屬銅與濃硫酸反應制備,該反應的化學方程式為________________________________________________________________________。
(2)CuSO4粉末常用來檢驗一些有機物中的微量水分,其原因是________________________________________________________________________。
(3)SO![]() 中S以sp3雜化,SO
中S以sp3雜化,SO![]() 的立體構型是________。
的立體構型是________。
(4)元素金(Au)處于周期表中的第六周期,與Cu同族,金原子最外層電子排布式為____________。一種銅合金晶體具有立方最密堆積的結構,在晶胞中銅原子處于面心,金原子處于頂點位置,則該合金中銅原子與金原子數量之比為________;該晶體中,原子之間的作用力是________________________________________________________________________。
(5)CuSO4晶體的構成微粒是________和________,微粒間的作用力是________,該晶體屬于________晶體。
(6)上述晶體具有儲氫功能,氫原子可進入到由銅原子與金原子構成的四面體空隙中。若將銅原子與金原子等同看待,該晶體儲氫后的晶胞結構與CaF2的結構相似,該晶體儲氫后的化學式應為________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有機花兒會務X(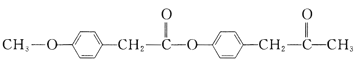 )是有機精細化工的重要中間體,實驗室中以M(
)是有機精細化工的重要中間體,實驗室中以M(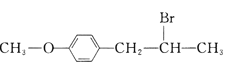 )為原料合成X的路線如下:
)為原料合成X的路線如下:
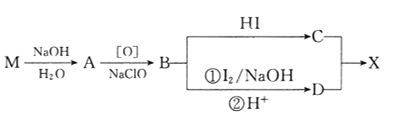

回答下列問題:
(1)B的核磁共振氫譜上有________組峰。
(2)D分子中含有的官能團有_________________________。(填名稱)
(3)下列常見含鈉試劑能與C反應的有______________。(填標號)
a.氯化鈉 b.氫氧化鈉 c.純堿 d.碳酸氫鈉
(4)由B轉化為C的化學方程式為______________________________,該反應的反應類型是_______________________。
(5)E是D的同分異構體,在苯環的對位上各有一個取代基,能夠發生銀鏡反應和水解反應,1molE與足量鈉反應可生成0.5molH2,則E可能的結構有_____種。
(6)有機物F( )也是一種重要的有機精細化工中間體,寫出由
)也是一種重要的有機精細化工中間體,寫出由 ![]() 制備F的合成路線。(其他試劑任選;已知馬氏規則:在不對稱烯烴的加成反應中,氫原子總是加在含氫較多的碳原子上。如:
制備F的合成路線。(其他試劑任選;已知馬氏規則:在不對稱烯烴的加成反應中,氫原子總是加在含氫較多的碳原子上。如:![]() )_________________.
)_________________.
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】1949年度諾貝爾化學獎授予為研究臭氧做出貢獻的化學家。臭氧能吸收有害紫外線,保護人類賴以生存的空間。O3分子的結構如圖:呈V形,鍵角116.5°。三個原子以一個O原子為中心,與另外兩個O原子分別構成一個非極性共價鍵;中間O原子提供2個電子,旁邊兩個O原子提供1個電子,構成一個特殊的化學鍵(虛線內部分)——三個O原子均等的享有著4個電子。請回答:
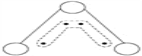
(1)題中非極性共價鍵是__鍵,特殊的化學鍵是 鍵。
(2)臭氧與氧氣是_____。
(3)下列物質的分子與O3分子的結構最相似的是_______。
A.H2O B.CO2 C.SO2 D.BeCl2
(4)子中某一原子有1對沒有跟其他原子共用的電子叫孤電子對,那么 O3分子有___對孤電子對。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】“胃舒平”的主要成分是氫氧化鋁,同時含有三硅酸鎂(Mg2Si3O8·nH2O)等化合物。下列敘述中錯誤的是( )
A. 鎂元素基態原子的核外電子排布式是:1s22s22p63s2
B. 鋁元素原子核外共有5種不同運動狀態的電子
C. 鈉元素離子半徑比鋁離子半徑大
D. 金屬鋁與鈉的最高價氧化物的水化物溶液發生反應的離子方程式為2Al+2OH-+2H2O===2AlO+3H2↑
【答案】B
【解析】試題分析:A.鎂元素基態原子的核外電子排布式是:1s22s22p63s2,A正確;B.鋁元素原子核外共有13種不同運動狀態的電子,B錯誤;C.鈉元素離子半徑比鋁離子半徑大,C正確;D.金屬鋁與鈉的最高價氧化物的水化物溶液發生反應的離子方程式為2Al+2OH-+2H2O===2AlO+3H2↑,D正確,答案選B。
考點:考查核外電子排布、微粒半徑等有關判斷
【題型】單選題
【結束】
17
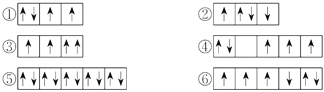
【題目】(1)以下列出的是一些原子的2p能級和3d能級中電子排布的情況,試判斷哪些違反了泡利原理__________,哪些違反了洪特規則__________。
(2)某元素的激發態(不穩定狀態)原子的電子排布式為1s22s22p63s13p33d2,則該元素基態原子的電子排布式為__________;其最高價氧化物對應水化物的化學式是__________。
(3)將下列多電子原子的原子軌道按軌道能量由低到高順序排列。
①2s ②3d ③4s ④3s ⑤4p ⑥3p
軌道能量由低到高排列順序是__________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com