
【題目】二氧化硫是造成大氣污染的主要有害氣體之一,工業制備硫酸的接觸室中二氧化硫不能完全轉化為三氧化硫,尾氣必須處理。某興趣小組模擬接觸室中反應,如圖是分別在三種不同實驗條件下進行反應,反應物二氧化硫的濃度隨時間的變化。
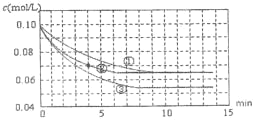
(1)工業制硫酸的接觸室中用二氧化硫與氧氣制三氧化硫的生產條件為_______。
(2)實驗②,0~4min 平均反應速率v(O2)=______。
(3)實驗③可能改變的條件是什么:______請簡述理由。______(已知正反應放熱)
(4)二氧化硫尾氣可以用氨水吸收,最終的產物可能有(NH4)2SO4、(NH4)2SO3、NH4HSO3。若三者的物質的量濃度相同時,銨根離子濃度由大到小的順序為______。
(5)濃硫酸是常見的干燥劑,請解釋不能干燥硫化氫與氨氣的原因_____。
【答案】常壓、催化劑、加熱 0.00375mol/(Lmin) 降低溫度 實驗③中反應達到平衡的時間增加,SO2的轉化率升高 (NH4)2SO4、(NH4)2SO3、NH4HSO3 濃硫酸具有強氧化性會氧化硫化氫,具有酸性會與氨氣反應
【解析】
(1)根據可逆反應的特點及化學反應速率、化學平衡移動原理分析;
(2)實驗②,先計算0-4min v(SO2)平均反應速率,然后根據不同物質的速率關系,計算v(O2);
(3)根據反應特點,結合達到平衡時間、平衡時SO2的含量判斷反應條件;
(4)根據鹽的組成判斷NH4+濃度的大小;
(5)根據氧化還原反應規律分析。
(1)SO2與O2生成SO3的反應為可逆反應,方程式為:2SO2+O2![]() 2SO3,由于升高溫度、使用催化劑可加快反應速率,縮短達到平衡所需要的時間,所以反應要在催化劑、加熱下進行,由于在常壓下反應物SO2的轉化率較大,若采用增大壓強的方法,盡管增大壓強,可以加快反應速率,可以使化學平衡正向移動,提高SO2的轉化率,但產生大的動力消耗較大的能量,而且對設備的材料投入相應的也增大,平衡移動SO2的轉化率增大不多,不經濟,因此一般就采用常壓條件下,加熱和使用催化劑進行反應;
2SO3,由于升高溫度、使用催化劑可加快反應速率,縮短達到平衡所需要的時間,所以反應要在催化劑、加熱下進行,由于在常壓下反應物SO2的轉化率較大,若采用增大壓強的方法,盡管增大壓強,可以加快反應速率,可以使化學平衡正向移動,提高SO2的轉化率,但產生大的動力消耗較大的能量,而且對設備的材料投入相應的也增大,平衡移動SO2的轉化率增大不多,不經濟,因此一般就采用常壓條件下,加熱和使用催化劑進行反應;
(2)對于實驗②,根據圖示可知在0~4min 內平均反應速率v(SO2)=![]() =0.0075 mol/(Lmin),由于用不同物質表示反應速率時,速率比等于化學計量數的比,所以v(O2)=
=0.0075 mol/(Lmin),由于用不同物質表示反應速率時,速率比等于化學計量數的比,所以v(O2)=![]() v(SO2)=
v(SO2)=![]() ×0.0075 mol/(Lmin)=0.00375mol/(Lmin);
×0.0075 mol/(Lmin)=0.00375mol/(Lmin);
(3)根據圖象可知:實驗③達到平衡所需時間長,說明反應速率減小,而且達到平衡時SO2的濃度降低,平衡含量降低,說明化學平衡正向移動,由于可逆反應2SO2+O2![]() 2SO3的正反應是氣體體積減小的放熱反應,則改變的條件是降低反應溫度;
2SO3的正反應是氣體體積減小的放熱反應,則改變的條件是降低反應溫度;
(4)若產生的三種鹽(NH4)2SO4、(NH4)2SO3、NH4HSO3的物質的量濃度相同,根據電離方程式(NH4)2SO4=2NH4++SO42-、(NH4)2SO3=2NH4++SO32-、NH4HSO3=NH4++HSO3-,可知銨根離子濃度最小的是NH4HSO3;(NH4)2SO4是強酸弱堿鹽,只存在NH4+的水解作用,而(NH4)2SO3是弱酸弱堿鹽,在溶液中NH4+、SO32-都發生水解反應,SO32-水解反應對NH4+的水解起促進作用,導致NH4+的濃度比(NH4)2SO4的小,所以若三者的物質的量濃度相同時,銨根離子濃度由大到小的順序為(NH4)2SO4、(NH4)2SO3、NH4HSO3;
(5)濃硫酸是常見的干燥劑,濃硫酸中+6價的S具有強的氧化性,因而使具有強氧化性,而H2S具有還原性,二者會發生氧化還原反應產生S和H2O,因此不能干燥硫化氫;濃硫酸具有酸性,會與堿性氣體氨氣反應產生硫酸銨,因此也不能用硫酸干燥氨氣。


科目:高中化學 來源: 題型:
【題目】用Cl2生產含氯有機物時會產生HCl。
利用反應__HCl(g)+__O2(g)__Cl2(g)+__H2O(g)可實現氯的循環利用。
完成下列填空:
(1)配平該化學方程式,并標出電子轉移的方向和數目。_____
(2)若將該反應設計成一原電池,則Cl2應在_____(填“正極”或“負極”)附近逸出。
(3)上述反應中所有元素原子半徑由大到小的順序為_____;與氯元素同族的短周期元素原子最外層電子排布式為____。
(4)判斷氯、溴非金屬性強弱的依據是____(選填序號)。
a.熔點:Cl2<Br2 b.氧化性:Cl2>Br2 c.熱穩定性:HCl>HBr d.酸性:HCl<HBr
(5)上述反應若在固定體積的密閉容器中發生,能說明反應已達平衡的是__(選填序號)。
a.2v(HCl)正=v(Cl2)逆 b.體系壓強不再改變
c.混合氣體密度不變 d.![]() =K
=K
(6)若反應容器容積為2L,4molHCl與1molO2混合氣體反應至8min時,測得容器內氣體壓強減小了10%,則用HCl表示的該反應的化學反應速率為___。
(7)圖是在4種不同投料比下,溫度對HCl平衡轉化率影響的曲線(![]() =1,2,4,6)
=1,2,4,6)

①曲線a對應的投料比![]() ____。
____。
②不改變投料比,使曲線b達到曲線d相同的HCl平衡轉化率,可采取的措施有____;____。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】北京奧運會祥云火炬的主要燃料為丙烷,下列關于丙烷的說法正確的是
A.丙烷分子中3個碳原子在一條直線上
B.丙烷可以與溴水發生取代反應
C.丙烷在空氣中燃燒只可能生成CO2和H2O
D.常溫常壓下,22g丙烷所含氫原子數為4NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】焦亞硫酸鈉(Na2S2O5)是常用的食品抗氧化劑之一。某研究小組進行如下實驗:
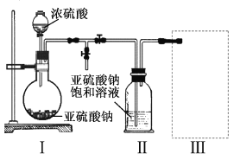
實驗一焦亞硫酸鈉的制取
采用如圖裝置(實驗前已除盡裝置內的空氣)制取Na2S2O5。裝置II中有Na2S2O5晶體析出,發生的反應為:
Na2SO3+SO2=Na2S2O5
(1)裝置I中產生氣體的化學方程式為 。
(2)要從裝置II中獲得已析出的晶體,可采取的分離方法是 。
(3)裝置III用于處理尾氣,可選用的最合理裝置(夾持儀器已略去)為 。(填序號)。
實驗二焦亞硫酸鈉的性質
Na2S2O5溶于水即生成NaHSO3。
(4)檢驗Na2S2O5晶體在空氣中已被氧化的實驗方案是 。
實驗三葡萄酒中抗氧化劑殘留量的測定
(5)葡萄酒常用Na2S2O5作抗氧化劑。測定某葡萄酒中抗氧化劑的殘留量(以游離SO2計算)的方案如下:

(已知:餾分中的二氧化硫在滴入碘水時發生的反應為
SO2+I2+2H2O=H2SO4+2HI)在測定時消耗了0.01mol·L-1的I2溶液25.00 mL,該次實驗測得樣品中抗氧化劑的殘留量(以游離SO2計算)為 g·L-1。在上述實驗過程中,若有部分HI被空氣氧化,則測得結果 (填“偏高”“偏低”或“不變”)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】可逆反應![]() ,在容積固定的密閉容器中達到平衡狀態的標志是( )
,在容積固定的密閉容器中達到平衡狀態的標志是( )
①單位時間內生成![]() 的同時生成
的同時生成![]()
②單位時間內生成![]() 的同時生成
的同時生成![]()
③用![]() 表示的反應速率之比為
表示的反應速率之比為![]() 的狀態
的狀態
④混合氣體的顏色不再改變的狀態
⑤混合氣體的密度不再改變的狀態
⑥混合氣體的壓強不再改變的狀態
⑦混合氣體的物質的量不再改變的狀態
A.①④⑥⑦B.②③⑤⑦C.①③④⑤D.全部
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知某條件下,合成氨反應的數據如下:
N2(g)+3H2(g)![]() 2NH3(g)
2NH3(g)
起始濃度/mol·L-1 1.0 3.0 0.2
2s末濃度/mol·L-1 0.6 1.8 1.0
4s末濃度/mol·L-1 0.4 1.2 1.4
當用氨氣濃度的增加來表示該反應的速率時,下列說法中錯誤的是 ( )
A. 2s末氨氣的反應速率=0.4mol·(L·s)-1
B. 前2s時間內氨氣的平均反應速率=0.4mol·(L·s)-1
C. 前4s時間內氨氣的平均反應速率=0.3mol·(L·s)-1
D. 2~4s時間內氨氣的平均反應速率=0.2mol·(L·s)-1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】溴苯是不溶于水的液體,常溫下不與酸、堿反應,可用如圖裝置制取(該反應放出熱量)。制取時觀察到錐形瓶中導管口有白霧出現等現象。下列說法錯誤的是
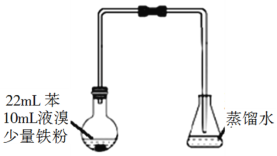
A. 制備溴苯的反應屬于取代反應
B. 裝置圖中長直玻璃導管僅起導氣作用
C. 該反應還可能看到燒瓶中有紅色蒸汽
D. 溴苯中溶有少量的溴,可用NaOH溶液洗滌除去
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)下列五個反應
A.5Cl2+I2+6H2O=10HCl+2HIO3
B.2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
C.2KMnO4+16HCl=2MnCl2+2KCl+5Cl2↑+8H2O
D.2NaCl+2H2O![]() 2NaOH+Cl2↑+H2↑
2NaOH+Cl2↑+H2↑
E.MnO2+4HCl![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
上述反應中氯元素只被氧化的是_____________,(填字母,下同)只被還原的是_____________,部分被氧化的是_____________,C中被氧化與被還原的物質的量之比為_____________。
(2)在反應4(NH4)2SO4![]() N2↑+6NH3↑+3SO2↑+SO3↑+7H2O中,氧化產物與還原產物的物質的量之比為___________,生成56gN2轉移的電子___________mol。
N2↑+6NH3↑+3SO2↑+SO3↑+7H2O中,氧化產物與還原產物的物質的量之比為___________,生成56gN2轉移的電子___________mol。
(3)飲用水中的NO3-對人類健康會產生危害,為了降低飲用水中NO3-的濃度,某飲用水研究人員提出,在堿性條件下用鋁粉將NO3-還原為N2,其化學方程式為:10A1+6NaNO3+4NaOH==10NaA1O2+3N2↑+2H2O。上述反應中,若產生2mol N2,轉移電子數為_________(用NA表示阿伏加德羅常數);用“雙線橋”表示反應中電子轉移,化合價的變化,反應類型:______________。
(4)將等質量的兩份鎂、鋁合金分別投入足量的NaOH和HCl中,在相同的情況下測得生成氣體的體積之比為1:2,求合金中鎂、鋁的物質的量之比為___________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用如圖裝置制取表中的四種干燥、純凈的氣體(圖中鐵架臺、鐵夾、加熱及氣體收集裝置均已略去;必要時可以加熱;a、b、c、d表示相應儀器中加入的試劑)。其中正確的是( )

選項 | 氣體 | a | b | c | d |
A | CO2 | 鹽酸 | CaCO3 | 飽和Na2CO溶液 | 濃硫酸 |
B | Cl2 | 濃鹽酸 | MnO2 | NaOH溶液 | 濃硫酸 |
C | NH3 | 飽和NH4Cl溶液 | 消石灰 | H2O | 固體NaOH |
D | NO | 稀硝酸 | 銅屑 | H2O | 濃硫酸 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com