
【題目】飽和二氧化硫水溶液中存在下列平衡體系:SO2+H2O![]() H++HSO3﹣ HSO3﹣
H++HSO3﹣ HSO3﹣![]() H++SO32﹣,若向此溶液中( )
H++SO32﹣,若向此溶液中( )
A.加水,SO32﹣濃度增大
B.通入少量Cl2氣體,溶液pH增大
C.加少量CaSO3粉末,HSO3﹣濃度基本不變
D.通入少量HCl氣體,溶液中HSO3﹣濃度減小
科目:高中化學 來源: 題型:
【題目】氮的氧化物是嚴重的大氣污染物,可以通過以下方法處理:
Ⅰ.催化還原法:如在汽車排氣管上安裝一個催化轉化器,發生如下反應: 2NO(g)+2CO(g)N2(g)+2CO2(g)
(1)已知N2(g)+O2(g)2NO(g) △H=+180kJ/mol
化學鍵 | O=O | C=O | C≡O |
鍵能(kJ/mol) | 497 | 803 | 1072 |
則反應:2NO(g)+2CO(g) N2(g)+2CO2(g) △H=_____kJ/mol。
(2)在一定溫度下,向體積為1L的密閉容器中充入2molNO、1molCO,10分鐘時反應2NO(g)+2CO(g)N2(g)+2CO2(g)達到平衡狀態,反應過程中反應物濃度隨時間變化情況如圖所示:
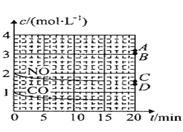
①該反應的平衡常數 K 的計算式為_____;前 10 分鐘內用氮氣表示的反應速率為_____。
②若保持溫度不變,15 分鐘時再向該容器中充入1.6molNO、0.4molCO2,則此時反應的ν正______ν逆(填“>”、“=”或“<”)。
③若保持其他條件不變,15min 時壓縮容器的體積至 0.5L,20 分鐘時反應重新達到平衡,NO 的濃度對應的點應是圖中的_____(填字母)。
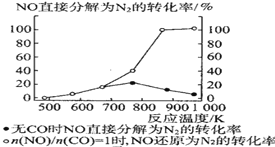
④某科研小組研究發現以 Ag-ZSM-5 為催化劑,NO 轉化為 N2 的轉化率隨溫度變化情況如圖所示。若不使用 CO,溫度超過775K,發現NO的分解率降低,其可能的原因是__________________
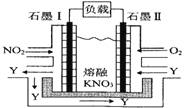
Ⅱ.利用電化學原理,將 NO2、O2和熔融 KNO3制成燃料電池,其原理如圖,該電池在工作過程中NO2轉變成綠色硝化劑Y,Y是一種氧化物,可循環使用,石墨Ⅰ附近發生的反應電極反應式為_____相同條件下,消耗的 O2和 NO2的體積比為_____
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】關于各圖的說法(其中①③④中均為情性電極)正確的是( )
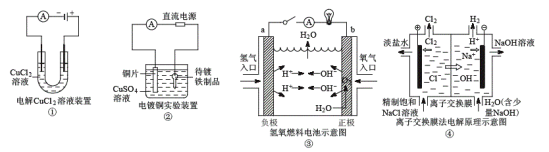
A.①裝置中陰極處產生的氣體能夠使濕潤KI淀粉試紙變藍
B.②裝置中待鍍鐵制品應與電源正極相連
C.③裝置中電子由b極流向a極
D.④裝置中的離子交換膜可以避免生成的Cl2與NaOH溶液反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】ClO2是一種高效、廣譜、安全的殺菌、消毒劑,易溶于水。制備方法如下:
(1)步驟Ⅰ:電解食鹽水制備氯酸鈉。用于電解的食鹽水需先除去其中的 Ca2+、Mg2+、SO42-等雜質。在除雜操作時,往粗鹽水中先加入過量的________(填化學式),至沉淀不再產生后,再加入過量的________和NaOH,充分反應后將沉淀一并濾去。
(2)步驟Ⅱ:將步驟Ⅰ得到的食鹽水在特定條件下電解得到氯酸鈉(NaClO3),再將它與鹽酸反應生成ClO2與Cl2,ClO2與Cl2的物質的量比是____________。
(3)學生擬用左下圖所示裝置模擬工業制取并收集ClO2,用NaClO3和草酸(H2C2O4)恒溫在60℃ 時反應制得。

反應過程中需要對A容器進行加熱,加熱的方式為____________;加熱需要的玻璃儀器除酒精燈外,還有_________________;
(4)反應后在裝置C中可得亞氯酸鈉(NaClO2)溶液。已知NaClO2飽和溶液在溫度低于38℃時,析出的晶體是NaClO2·3H2O,在溫度高于38℃時析出的是NaClO2。根據右上圖所示NaClO2的溶解度曲線,請完成從NaClO2溶液中制得NaClO2·3H2O的操作步驟:
①_____________;②_______________;③洗滌;④干燥。
(5)目前我國已成功研制出利用NaClO2制取二氧化氯的新方法,將Cl2通入到NaClO2溶液中。現制取270kg二氧化氯,需要亞氯酸鈉的質量是________。
(6)ClO2和Cl2均能將電鍍廢水中的劇毒CN-氧化為無毒物質,自身被還原為Cl-。處理含CN-相同量的電鍍廢水,所需Cl2的物質的量是ClO2的_______倍。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】3-羥基丁酸(3-hydroxybutyrate)也稱為β-羥基丁酸(beta-hydroxybutyrate),在工業中可用于合成可生物降解的塑料,如聚(3-羥基丁酸)。
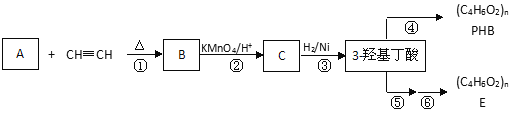
已知:i. 共軛二烯烴(如異戊二烯)與含有碳碳叁鍵的有機物作用時能形成環狀化合物:
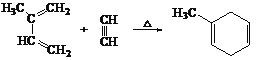
ii. 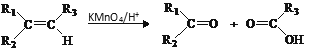
iii. 步驟②只有一種產物;E的結構中含有甲基
(1)A分子結構簡式 _______;理論上B也可以由1,3-丁二烯與烴F來合成,則F的名稱(系統命名法):_________;C中含有的官能團是_______(用符號表示)。
(2)寫出反應類型:②_____________, ④_____________。
(3)PHB______(填“有”或“無”)固定熔沸點;它與E______(填“互為”或“不互為”)同分異構體。下列有機物具有類似共軛二烯烴性質的是__________(填序號);
a. ![]() b.
b. ![]()
c. ![]() d.
d. 
(4)寫出反應⑤的化學方程式________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖為以Pt為電極的氫氧燃料電池的工作原理示意圖,稀H2SO4溶液為電解質溶液。下列有關說法不正確的是

A. a極為負極,電子由a極經外電路流向b極
B. a極的電極反應式:H2-2e-===2H+
C. 電池工作一段時間后,裝置中c(H2SO4)增大
D. 若將H2改為CH4,消耗等物質的量的CH4時,O2的用量增多
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】普通電解精煉銅的方法所制備的銅中仍含雜質,利用下面的雙膜( 陰離子交換膜和過濾膜)電解裝置可制備高純度的Cu。下列有關敘述正確的是

A. 電極a為粗銅,電極b為精銅
B. 甲膜為過濾膜,可阻止陽極泥及漂浮物雜質進入陰極區
C. 乙膜為陰離子交換膜,可阻止雜質陽離子進入陰極區
D. 當電路中通過1mol電子時,可生成32g精銅
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在加熱固體NH4Al(SO4)212H2O時,固體質量隨溫度的變化曲線如圖所示:已知A點物質為NH4Al(SO4)2,B點物質為Al2(SO4)3,下列判斷正確的是( )
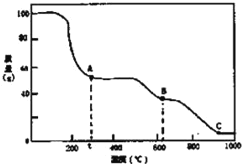
A.0℃→t℃的過程變化是物理變化
B.C點物質是工業上冶煉鋁的原料
C.A→B反應中生成物只有Al2(SO4)3和NH3兩種
D.Al2(SO4)3能夠凈水,其原理為:Al3++3OH-![]() Al(OH)3
Al(OH)3
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某混合物A含有KAl(SO4)2、Al2O3和Fe2O3,在一定條件下可實現下圖所示的物質之間的變化:

據此回答下列問題:
(1)I、II、III、IV四步中對于溶液和沉淀的分離采取的方法是____________。
(2)根據上述框圖反應關系,寫出下列B、D、E所含物質的化學式
固體B_________________;沉淀D __________________;
溶液E_________________________________________。
(3)寫出①、④兩個反應的化學方程式
①__________________________________;④_____________________________。
(4)寫出②、③兩個反應的離子方程式
②_________________________________;③______________________________。
(5)設計實驗檢驗溶液F中所含溶質:______________________________________
(6)分別寫出Al2O3和Fe2O3在工業上的一種主要用途:
Al2O3__________________________Fe2O3____________________________
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com