
【題目】在一定體積的密閉容器中進行化學反應CO2(g)+H2(g)CO(g)+H2O(g),其化學平衡常數K和溫度T的關系如表所示

請回答下列問題:
(1)該反應的正反應為______(填“吸熱”或“放熱”)反應,
(2)某溫度下,在2L的密閉容器中,加入 1molCO2和 1mol H2,充分反應達平衡時,CO的平衡濃度為0.25mol/L,試判斷此時的反應溫度為________
(3)若在(2)所處的溫度下,在1L的密閉容器中,加入2moCO2和3 mol H2,則充分反應達平衡時,H2的物質的量______
A.等于1.0mol B.大于1.0mol
C.大于0.5mol,小于1.0mol D.無法確定
【答案】吸熱 830 B
【解析】
(1)由表中數據可知,溫度越高平衡常數越大,說明升高溫度平衡向正反應移動,溫度升高平衡向吸熱反應移動;
(2)計算平衡時各物質的量的濃度,再根據k=c(CO)·c(H2O)/c(CO2)·c(H2)計算平衡常數判斷溫度;
(3)令平衡時參加反應的CO2的物質的量為ymol,則:
CO2(g)+H2(g)![]() CO(g)+H2O(g)
CO(g)+H2O(g)
開始(mol):2 3 0 0
變化(mol):y y y y
平衡(mol):2-y 3-y y y
再根據平衡常數k=c(CO)·c(H2O)/c(CO2)·c(H2)=1列方程計算解答.
(1)由表中數據可知,溫度越高化學平衡常數越大,升高溫度平衡向正反應移動,溫度升高平衡向吸熱反應移動,故該反應正反應是吸熱反應;
(4)某溫度下,在2L的密閉容器中,加入1molCO2和1molH2充分反應達平衡時,CO平衡濃度為0.25mol·L-1,則:
CO2(g)+H2(g)![]() CO(g)+H2O(g)
CO(g)+H2O(g)
起始濃度(mol):0.5 0.5 0 0
變化濃度(mol):0.25 0.25 0.25 0.25
平衡濃度(mol):0.25 0.25 0.25 0.25
平衡常數K=![]() =1,
=1,
故所處溫度為830℃;
令平衡時參加反應的CO2的物質的量為ymol,則:
CO2(g)+H2(g)![]() CO(g)+H2O(g)
CO(g)+H2O(g)
開始(mol):2 3 0 0
變化(mol):y y y y
平衡(mol):2-y 3-y y y
再根據平衡常數k=c(CO)·c(H2O)/c(CO2)·c(H2)=1
則平衡常數K=![]() =1,解得y=1.2,故平衡時H2的物質的量為3mol-1.2mol=1.8mol。
=1,解得y=1.2,故平衡時H2的物質的量為3mol-1.2mol=1.8mol。
故選B。


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
【題目】下列有關化合物X、Y的說法不正確的是( )
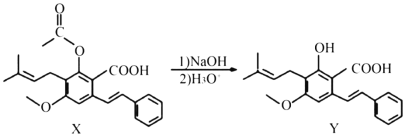
A.1 mol X最多能與2 mol NaOH反應
B.Y與乙酸發生酯化反應可得到X
C.X、Y均能與酸性KMnO4溶液反應
D.室溫下,X、Y分別與足量Br2加成的產物分子中的手性碳原子數目相等
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】二氧化硫是重要的化工原料,用途非常廣泛。
實驗一:SO2可以抑制細菌滋生,具有防腐功效。某實驗小組欲用下圖所示裝置測定某品牌葡萄酒中(葡萄酒中含有乙醇、有機酸等)的SO2含量。
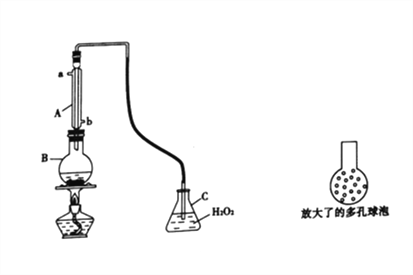
(1)儀器A的名稱是________;使用該裝置主要目的是____________________。
(2)B中加入 300.00 mL葡萄酒和適量鹽酸,加熱使SO2全部逸出并與C中H2O2完全反應,C中化學方程式為_________________________________________。
(3)將輸入C裝置中的導管頂端改成具有多孔的球泡(如圖15所示)。可提高實驗的準確度,理由是_______________________________________。
(4)除去C中的H2O 然后用0.099mol·L-1NaOH標準溶液滴定。
①用堿式滴定管量取0.09mol·L-1NaOH標準溶液前的一步操作是___________________________;
②用該方法測定葡萄酒中SO2的含量偏高,主要原因是__________________________________,利用現有的裝置,提出改進的措施是_______________________________________________。
(5)利用C中的溶液,有很多實驗方案測定葡萄酒中SO2的含量。現有0.1mol·L-1BaCl2溶液,實驗器材不限,簡述實驗步驟:________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在一個6L的密閉容器中,放入3LX(g)和2LY(g),在一定條件下發生下列反應:4X(g)+3Y(g)2Q(g)+nR(g)達到平衡后,容器內溫度不變,混合氣體的壓強比原來增加5%,X的濃度減小1/3,則該反應方程式中的n的值是
A.3B.4C.5D.6
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】濃硫酸和木炭在加熱時發生反應的化學方程式是2H2SO4(濃)+C![]() CO2↑+2H2O+2SO2↑。用如圖所示裝置設計一個實驗,驗證濃硫酸與木炭粉在加熱條件下反應產生的各種產物。
CO2↑+2H2O+2SO2↑。用如圖所示裝置設計一個實驗,驗證濃硫酸與木炭粉在加熱條件下反應產生的各種產物。
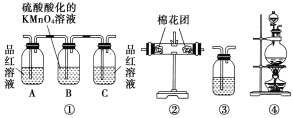
(1)這些裝置的連接順序(按產物氣流從左到右的方向)是____→___→____→____。(填裝置的序號)
(2)裝置②中要檢驗產物中有水蒸氣,則放入的藥品是______;裝置③中要檢驗產物中有二氧化碳氣體,則放入的藥品是___________;實驗時可觀察到裝置①中A瓶的溶液褪色,C瓶的溶液不褪色,A瓶溶液的作用是_______,B瓶溶液的作用是_________,C瓶溶液的作用是______________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某溫度下,40 g、10%硝酸鈉溶液與60 g、7.5%的硝酸鈉溶液混合,得到密度為1.20 g·cm-3的混合溶液,計算:
(1)該混合溶液中溶質的質量分數為__;
(2)該混合溶液中NaNO3的物質的量濃度為__。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用雙線橋法標出下列反應電子轉移的方向和數目。
(1)4HCl(濃)+MnO2![]() MnCl2+Cl2↑+2H2O_________________
MnCl2+Cl2↑+2H2O_________________
(2)2KClO3![]() 2KCl+3O2↑__________
2KCl+3O2↑__________
(3)Cl2+2NaOH===NaClO+NaCl+H2O__________
(4)2H2O2![]() 2H2O+O2↑__________
2H2O+O2↑__________
(5)S+2H2SO4(濃)![]() 3SO2↑+2H2O__________
3SO2↑+2H2O__________
(6)6HCl+KClO3===3Cl2↑+KCl+3H2O__________
(7)3Cu+8HNO3===3Cu(NO3)2+2NO↑+4H2O__________
(8)2KMnO4![]() K2MnO4+MnO2+O2↑__________
K2MnO4+MnO2+O2↑__________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鋅與100 mL 18.5 mol·L-1的濃硫酸充分反應后,鋅完全溶解,同時生成氣體甲33.6 L(標準狀況)。將反應后的溶液稀釋至1 L,測得溶液中氫離子濃度為0.1 mol·L-1。下列敘述不正確的是( )
A.反應中共消耗1.8 mol 硫酸B.氣體甲中二氧化硫與氫氣的體積比為4∶1
C.反應中共消耗97.5 g 鋅D.反應中共轉移3 mol電子
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在大試管內將足量NaHCO3加熱到 200℃,將產生的混合氣體通入到盛有1.87 g Na2O和Na2O2的密閉容器中,待Na2O和Na2O2全部反應后,得到標準狀況下224 mL O2;再將反應后密閉容器內的固體全部溶于水配成 100 mL 溶液。下列說法正確的是
A.Na2O和Na2O2 均為堿性氧化物
B.參加反應的NaHCO3物質的量為 0.04 mol
C.反應過程中總共轉移 0.04 mol 電子
D.配成的 100 mL 溶液中 c(Na+) = 0.5 mol/L
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com