
【題目】肼(N2H4)是一種重要的化工原料,既可用于制藥,又可用作火箭燃料。回答下列問題:
(1)已知反應的熱化學方程式如下:
①N2H4(g)![]() N2(g)+2H2(g) △H1;
N2(g)+2H2(g) △H1;
②N2(g)+3H2(g)![]() 2NH3(g) △H2。
2NH3(g) △H2。
反應熱△H1 _____(填“大于”或“小于”) △H2。向2 L的恒容密閉容器中充入1 mol N2H4,發生反應①,![]() (用x表示)與時間的關系如圖1所示,則該溫度下,反應①的平衡常數K=___________________。
(用x表示)與時間的關系如圖1所示,則該溫度下,反應①的平衡常數K=___________________。

(2)肼在另一條件下也可達到分解平衡,同時生成兩種氣體,且其中一種氣體能使濕潤的紅色石蕊試紙變藍。圖2為平衡體系中肼的體積分數與溫度、壓強的關系。
①該反應的化學方程式為________________________________________。
②p2_______ (填“大于”或“小于”) p1。
③圖中N2H4的平衡體積分數隨溫度升高而降低,其原因是__________________________________。
【答案】 大于 0.25 3N2H4![]() 4NH3+N2 小于 肼在催化劑作用下分解,正反應為吸熱反應,升髙溫度,平衡正向移動,因此肼的體積分數也減小
4NH3+N2 小于 肼在催化劑作用下分解,正反應為吸熱反應,升髙溫度,平衡正向移動,因此肼的體積分數也減小
【解析】(1)①N2H4(g)![]() N2(g)+2H2(g) 為分解反應,屬于吸熱反應,△H1>0;②N2(g)+3H2(g)
N2(g)+2H2(g) 為分解反應,屬于吸熱反應,△H1>0;②N2(g)+3H2(g)![]() 2NH3(g) 為化合反應,屬于放熱反應,△H2<0,反應熱△H1大于△H2。設反應的N2H4的物質的量為y,
2NH3(g) 為化合反應,屬于放熱反應,△H2<0,反應熱△H1大于△H2。設反應的N2H4的物質的量為y,
N2H4(g)![]() N2(g)+2H2(g)
N2(g)+2H2(g)
起始(mol)1 0 0
反應 y y 2y
平衡 1-y y 2y
則![]() =
=![]() =3.0,解得y=0.5mol,因此K=
=3.0,解得y=0.5mol,因此K=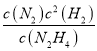 =
=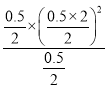 =0.25,故答案為:大于;0.25;
=0.25,故答案為:大于;0.25;
(2)①氣態肼在催化劑作用下分解只產生兩種氣體,其中一種氣體能使濕潤的紅色石蕊試紙變藍色,可推斷兩種氣體分別為N2和NH3,反應方程式為:3N2H4![]() N2+4NH3,故答案為:3N2H4
N2+4NH3,故答案為:3N2H4![]() N2+4NH3;
N2+4NH3;
②反應為氣體物質的量增大的反應,減小壓強有利于化學平衡向正反應方向移動,達到平衡時,肼的體積分數減小,根據圖像,壓強大小關系為:p2<p1,故答案為:小于;
③N2H4的平衡體積分數隨溫度升高而降低,可能的原因為肼在催化劑作用下分解,正反應為吸熱反應,升髙溫度,平衡正向移動,因此肼的體積分數也減小,故答案為:肼在催化劑作用下分解,正反應為吸熱反應,升髙溫度,平衡正向移動,因此肼的體積分數也減小。


科目:高中化學 來源: 題型:
【題目】有一種新型的乙醇電池,它用磺酸類質子溶劑,在200 ℃左右時供電,乙醇電池比甲醇電池效率高出32倍且更安全。電池總反應為C2H5OH+3O2===2CO2+3H2O,電池示意如圖,下列說法不正確的是( )

A. a極為電池的負極
B. 電池工作時,電流由b極沿導線經燈泡再到a極
C. 電池正極的電極反應為4H++O2+4e-===2H2O
D. 電池工作時,1 mol乙醇被氧化時就有6 mol電子轉移
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列化合物中,既不能與NaOH溶液發生反應,又不能與溴的CCl4溶液反應,也不能使酸性KMnO4溶液褪色的是( )
A.丙烷B.乙醇C.鹽酸D.乙烯
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】0.5L 1mol/L FeCl3溶液與0.2L 1mol/L KCl溶液中的Cl﹣的物質的量濃度之比( )
A.5:2
B.3:1
C.15:2
D.1:3
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】咖啡酸具有止血功效,存在于多種中藥中,其結構簡式如下圖,下列說法不正確的是
![]()
A. 咖啡酸可以發生取代、加成、氧化、酯化、加聚反應
B. 1mol 咖啡酸最多能與5 mol H2反應
C. 咖啡酸分子中所有原子可能共面
D. 蜂膠的分子式為C17H16O4,在一定條件下可水解生成咖啡酸和一種一元醇A,則醇A 的分子式為C8H10O
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】短周期主族元素A、B、C、D 原子序數依次增大且最外層電子數之和為17。B、D 同主族,短周期中C原子半徑最大,B最外層電子數是次外層的3倍。下列推斷不正確的是
A. 元素B、C、D 形成的化合物的水溶液呈中性
B. 元素B、C 形成的化合物中可能既含有離子鍵又含共價鍵
C. 離子半徑從大到小的順序為D>B>C
D. 元素B 的簡單氣態氫化物的熱穩定性比D 的強
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知某化學反應的平衡常數表達式為K=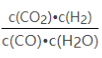 ,在不同的溫度下該反應的平衡常數如下表:
,在不同的溫度下該反應的平衡常數如下表:

下列有關敘述不正確的是( )
A. 該反應的化學方程式是CO(g)+H2O(g)![]() CO2(g)+H2(g)
CO2(g)+H2(g)
B. 上述反應的正反應是放熱反應
C. 若在一定體積的密閉容器中通入CO2和H2各1mol,5 min后溫度升高到830℃,此時測得CO2為0.4 mol時,該反應達到平衡狀態
D. 若平衡濃度符合下列關系式: ![]() ,則此時的溫度為1000℃
,則此時的溫度為1000℃
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com