
【題目】某工廠的廢金屬屑中主要成分為Cu、Fe和Al,此外還含有少量Al2O3和Fe2O3,為探索工業廢料的再利用,某化學興趣小組設計了如下實驗流程,用該工廠的合金廢料制取氯化鋁、綠礬晶體(FeSO4·7H2O)和膽礬晶體。
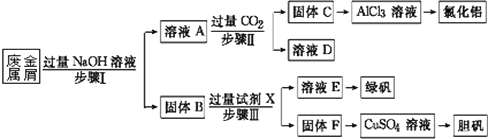
請回答:
(1)寫出步驟Ⅰ中Al與NaOH溶液反應的離子方程式_________。
(2)試劑X是_______;固體F是______。
(3)在步驟Ⅱ時,用如圖裝置制取CO2并通入溶液A中。一段時間后,觀察到燒杯中產生
的白色沉淀會逐漸減少。為避免固體C減少,可在a和b間加一個盛有飽和____溶液的洗氣瓶,其作用是______。

(4)使用FeSO4時,如要防止Fe3+的干擾,可以加入適量鐵粉進行除雜,寫出加入鐵粉后發生反應的離子方程式________。
【答案】2Al+2OH-+6H2O=2[Al(OH)4]-+3H2↑ 稀硫酸 銅 NaHCO3 除去CO2中的HCl氣體 2Fe3++Fe=3Fe2+
【解析】
Fe、Cu、Fe2O3都不與NaOH溶液反應,Al和Al2O3可與NaOH溶液反應,用含有Al、Fe、Cu和Al2O3、Fe2O3的廢金屬屑制取AlCl3、綠礬晶體(FeSO47H2O)和膽礬晶體流程為:合金中Al、Al2O3與NaOH反應,所得濾液A為NaAlO2溶液,經途徑Ⅱ與足量CO2發生反應:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,反應生成Al(OH)3固體C,生成的Al(OH)3再和鹽酸反應生成AlCl3,得到的AlCl3較純凈;溶液D為NaHCO3溶液;濾渣B為Fe、Cu及Fe2O3,為了獲得綠礬,根據元素守恒,加入足量稀硫酸,得到的濾液E為FeSO4,經蒸發濃縮、冷卻結晶可得到綠礬,濾渣F為Cu,可用于制備膽礬,以此解答該題。
(1) 步驟Ⅰ中Al與NaOH溶液反應產生四羥基合鋁酸鈉和氫氣,反應的離子方程式2Al+2OH-+6H2O=2[Al(OH)4]-+3H2↑;
(2)固體B是Fe、Cu、Fe2O3的混合物,向其中加入稀硫酸,金屬銅和稀硫酸不反應,但是金屬鐵可以和稀硫酸反應生成硫酸亞鐵和氫氣,氧化鐵與硫酸反應生成硫酸鐵,硫酸鐵與鐵化合成硫酸亞鐵,進而制得綠礬晶體,所以試劑X為稀硫酸,固體F是Cu單質;
(3)進行步驟Ⅱ時,該小組用如圖2所示裝置及試劑將制得的CO2氣體通入溶液A中,一段時間后,觀察到燒杯中產生的白色沉淀逐漸減少,其原因是二氧化碳氣體中含有從鹽酸中揮發出的HCl氣體,氯化氫在水中溶解了部分Al(OH)3沉淀,發生的反應為Al(OH)3+3H+=Al3++3H2O,為了避免固體C減少,可在制取二氧化碳的裝置與收集裝置之間增加一個洗去HCl的裝置,同時不溶解CO2,二氧化碳在飽和NaHCO3中難溶,氯化氫和NaHCO3反應生成二氧化碳氣體,所以可在裝置a和b之間增加一個盛有飽和NaHCO3溶液的洗氣瓶,除去二氧化碳中的氯化氫;
故答案為:在裝置a和b之間增加一個盛有飽和NaHCO3溶液的洗氣瓶,除去HCl;
(4) 使用FeSO4時,如要防止Fe3+的干擾,可以加入適量鐵粉進行除雜,這時Fe單質與Fe3+發生氧化還原反應產生Fe2+,該反應的離子方程式為2Fe3++Fe=3Fe2+,從而達到除雜的目的。


科目:高中化學 來源: 題型:
【題目】食物所供應的廣大營養素中,__________、__________和____________________能在人體中_________(填“氧化” 或“還原” ),供給人體所需要的能量。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知下列元素的原子半徑
原子 | N | S | O | Si |
半徑/10-10m | 0.75 | 1.02 | 0.74 | 1.17 |
根據以上數據,磷原子的半徑可能是
A.0.80×10-10mB.1.10×10-10mC.1.20×10-10mD.0.70×10-10m
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】Ⅰ.在0.1 mol·L-1的重鉻酸鉀(K2Cr2O7)溶液中存在如下平衡:
Cr2O72-+H2O![]() 2HCrO4
2HCrO4![]() 2CrO42-+2H+
2CrO42-+2H+
(1)重鉻酸鉀溶液呈______性,在強堿溶液中,鉻元素的主要存在形式為________(填離子符號),向重鉻酸鉀溶液中加入適量稀硫酸,溶液中c(Cr2O72-)/c(CrO42-)將______(填“增大”、“減小”或“不變”)。
Ⅱ.已知某溶液中只存在OH-、H+、NH4+、Cl-四種離子,某同學推測該溶液中各離子濃度大小順序可能有如下四種關系:并按要求填寫下列空白:
①c(Cl-)>c(NH4+)>c(H+)>c(OH-) ②c(Cl-)>c(NH4+)>c(OH-)>c(H+)
③c(NH4+)>c(Cl-)>c(OH-)>c(H+) ④c(Cl-)>c(H+)>c(NH4+)>c(OH-)
(1)若溶液中只溶解了一種溶質,則該溶質是 ________,上述四種離子濃度的大小順序為________(選填序號)。
(2)若上述關系中③是正確的,則溶液中的溶質為________;
(3)若該溶液是由體積相等的稀鹽酸和氨水混合而成,且恰好呈中性,則混合前c(HCl)_______c(NH3·H2O) (填“大于”“小于”或“等于”)。
III.重金屬離子對河流海洋造成嚴重污染。某化工廠廢水(pH=2.0,d≈1 g·mL-1)中含有Ag+,Pb 2+等重金屬離子,其濃度各約為0.0lmol·L-1。排放前擬用沉淀法除去這兩種
離子,查找有關數據如下:
難溶電解質 | AgI | AgOH | Ag2S | PbI2 | Pb(OH)2 | PbS |
Ksp | 8.3×10-17 | 5.6×10-8 | 6.3×10-50 | 7.1×10-9 | 1.2×10-15 | 3.4×10-28 |
(1)你認為往廢水中投入________________(填字母序號),沉淀效果最好。
A. NaOH B.Na2S C.KI D. Ca(OH)2
(2)如果用生石灰處理上述廢水,使溶液的pH=8.0,處理后的廢水中c(Pb2+)=_______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在元素周期表中位于金屬元素和非金屬元素交界處最容易找到的材料是( )
A.半導體材料
B.耐高溫、耐腐蝕的合金材料
C.制農藥的材料
D.制催化劑的材料
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將下列晶體熔化:氫氧化鈉、金剛石、硫化鉀、干冰,需要克服的微粒間的相互作用①共價鍵②離子鍵③分子間作用力,正確的順序是( )
A.①②②③B.②①②③C.②③②①D.①①②③
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】元素周期表隱含著許多信息和規律。以下所涉及的元素均為中學化學中常見的短周期元素,其原子半徑及主要化合價列表如下,其中R2Q2用于呼吸面具或潛水艇中作為氧氣來源。

下列說法正確的是
A. T、Z的最高價氧化物對應水化物的酸性T<Z
B. R、X、Y的單質失去電子能力最強的是X
C. M與Q形成的是離子化合物
D. M、Q、Z都在第2周期
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法正確的是( )
A.淀粉和纖維素互為同系物
B.水可以用來分離苯和苯酚的混合物
C.植物油氫化過程中發生了還原反應
D.環己烯與甲苯可用酸性KMnO4溶液鑒別
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com