
【題目】下列敘述正確的是( )
A.同溫同壓下,相同體積的物質,其物質的量一定相等
B.等物質的量的甲烷和一氧化碳所含的分子數前者大于后者
C.1L一氧化碳氣體一定比1L氧氣的質量小
D.相同條件下的一氧化碳和氮氣,若氣體體積相等,則質量也相等
科目:高中化學 來源: 題型:
【題目】用NA表示阿伏加德羅常數的值,下列有關說法正確的是
A. 足量的銅與40mL 10mol/L 硝酸反應,生成氣體的分子數為0.2NA
B. 1.0L 1.0mol·L-1Na2SO4 水溶液中含有的氧原子數為4NA
C. 電解飽和食鹽水,當陰極產生1.12LH2時,轉移的電子數為0.1NA
D. 4.4g乙醛和丁酸的混合物完全燃燒,消耗氧分子的數目為0.25NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一種通過鐵基氧載體(Fe3O4/FeO)深度還原和再生來合成二甲醚(CH3OCH3)的原理如下圖:

(1)二甲醚的合成反應:3CO(g)+3H2(g) ![]() CH3OCH3(g)+CO2(g) ΔH1
CH3OCH3(g)+CO2(g) ΔH1
①已知CO、H2與CH3OCH的燃燒熱(ΔH)分別為a kJ·mol-1、b kJ·mol-1、c kJ·mol-1、(a、b、c均小于0),則ΔH1=________kJ·mol-1。
②該反應選用CuO/ZnO/Al2O3復合催化劑,該催化劑能_______(填標號)。
A.促進平衡正向移動 B.提高反應速率
C.降低反應的活化能 D.改變反應的焓變
(2)CH4氧化器中發生的主反應:
ⅰ. CH4(g)+Fe3O4(s)![]() CO(g)+2H2(g)+3Fe(s)
CO(g)+2H2(g)+3Fe(s)
ⅱ. CH4(g)+4Fe3O4(s)![]() CO2(g)+2H2O(g)+12FeO(s)
CO2(g)+2H2O(g)+12FeO(s)
850℃時,壓強和部分氣體體積分數、固相各組分質量分數的關系如下圖。

①隨著壓強的增大,反應ⅰ的平衡常數K值________(填“增大”、“減小”、 或“不變”)
②結合圖像,分析H2O的體積分數變化的原因_________(用化學方程式表示)
(3)將一定量的FeO和CO2置于CO2還原器(體積不變的密閉容器)中,發生的主反應:
CO2(g)+3FeO(s)![]() Fe3O4(s)+ CO (g) ΔH2
Fe3O4(s)+ CO (g) ΔH2
保持其他條件不變,測得不同溫度下最終反應體系中CO、CO2體積分數如下表:
溫度I/℃ | 100 | 170 | 200 | 300 | 400 | 500 |
CO2體積分數 | 0.67 | 0.67 | 0.75 | 0.82 | 0.9 | 0.92 |
CO體積分數 | 0.33 | 0.33 | 0.25 | 0.18 | 0.1 | 0.08 |
①ΔH2_______0(填“>”或“<”)。
②若在150℃時進行上述轉化,理論轉化率ɑ(FeO)=___________。
③在上述反應體系中,一定可以說明該反應達到平衡狀態的是______(填標號)。
A.體系的壓強不變 B.CO2的物質的量不變
C.CO的生成速率和消耗速率相等且不等于零 D.氣體的平均摩爾質量不變
④根據化學反應原理,分析CO2還原器溫度設置在170℃的原因___________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】關于氫鍵的下列說法中正確的是( )
A. 每個水分子內含有兩個氫鍵
B. 在單個水分子、水蒸氣、液態水、冰中都存在氫鍵
C. 分子間能形成氫鍵使物質的熔沸點升高
D. HF的熱穩定性很強,是因為其分子間能形成氫鍵
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下,下列各組離子在指定溶液中能大量共存的是( )
A. 無色透明溶液:Al3+、NH4+、Cl-、S2-
B. 中性溶液:Al3+、Fe3+、SO42-、NO3-
C. 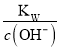 =1×10-13mol·L-1的溶液:Na+、K+、SiO32-、CO32-
=1×10-13mol·L-1的溶液:Na+、K+、SiO32-、CO32-
D. 0.1mol·L-1的NaClO溶液:Mg2+、Fe2+、SCN-、SO42-
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】圖1是銅鋅原電池示意圖。圖2中,x軸表示實驗時流入正極的電子的物質的量,y軸表示( ) 
A. 銅棒的質量
B. 鋅棒的質量
C. 氫離子的濃度
D. 硫酸根離子的濃度
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】Ⅰ.高鐵酸鉀(K2FeO4)是一種新型、高效、多功能綠色水處理劑,比Cl2、O2、ClO2、KMnO4氧化性更強,無二次污染,工業上是先制得高鐵酸鈉,然后在低溫下,向高鐵酸鈉溶液中加入KOH至飽和,使高鐵酸鉀析出。
(1)干法制備高鐵酸鈉的主要反應為:2FeSO4 + 6 Na2O2 = 2Na2FeO4 + 2Na2O + 2Na2SO4 + O2↑,該反應中氧化劑是________________(填化學式),過氧化鈉(Na2O2)中氧元素化合價為____________。(填數字)
(2)濕法制備高鐵酸鉀(K2FeO4)的反應體系中有六種數粒:Fe(OH)3、ClO-、OH-、FeO42-、Cl-、H2O。
①堿性條件下,氧化劑和還原劑的物質的量的比為3:2發生反應,寫出并配平濕法制高鐵酸鉀的離子反應方程式:___________________________________________________________。
②每生成1mol FeO42-轉移________mol電子,若反應過程中轉移了0.3mol電子,則還原產物的物質的量為______________mol。
Ⅱ.已知:2Fe3++2I-=2Fe2++I2,2Fe2++Br2=2Fe3++2Br-。
(1)含有1 mol FeI2和2 mol FeBr2的溶液中通入2 mol Cl2,此時被氧化的離子是____________,被氧化的離子的物質的量分別是________________________。
(2)若向含a mol FeI2和b mol FeBr2的溶液中通入c mol Cl2,當I-、Fe2+、Br-完全被氧化時,c為________________________(用含a、b的代數式表示)。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com