
【題目】密閉容器中充有10molCO與20molH2,在催化劑作用下反應生成甲醇:CO(g)+2H2(g)CH3OH(g);CO的平衡轉化率(α)與溫度、壓強的關系如圖所示。下列說法正確的是( )
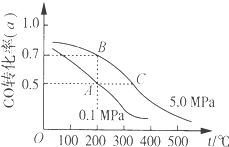
A.若A、B兩點表示在某時刻達到的平衡狀態,則A、B兩點時容器內總氣體的物質的量,n(A):n(B)=4:5
B.若A、C兩點都表示已達到的平衡狀態,則從反應開始至到達平衡狀態所需的時間tA>tC
C.設B、C兩點的平衡常數分別為KB、KC,則KB<KC
D.在不改變反應物用量的情況下,采取降溫、減壓或將甲醇從混合體系中分離出來均可提高CO的轉化率
【答案】B
【解析】
A.A點CO的轉化率為0.5,則參加反應的CO為10mol×0.5=5mol,則:
CO(g)+2H2(g)CH3OH(g)氣體物質的量減少
1 2
5mol 10mol
故A點平衡時,混合氣體總的物質的量=10mol+20mol-10mol=20mol;
B點CO的轉化率為0.7,則參加反應的CO為10mol×0.7=7mol,則:
CO(g)+2H2(g)CH3OH(g)氣體物質的量減少
1 2
7mol 14mol
故B點平衡時,混合氣體總的物質的量=10mol+20mol-14mol=16mol;
故A、B兩點時容器內總氣體的物質的量之比n(A):n(B)=20mol:16mol=5:4,故A錯誤;
B.C點的溫度、壓強都高于A點,溫度越高、壓強越大,反應速率越快,最先到達平衡,故從反應開始至到達平衡狀態所需的時間tA>tC,故B正確;
C.由圖可知,一定壓強下,溫度越高,CO的轉化率越低,說明升高溫度平衡向逆反應方向移動,B的溫度低于C點,故平衡常數KB>KC,故C錯誤;
D.正反應是氣體體積減小的反應,減壓平衡向逆反應方向移動,CO的轉化率降低,故D錯誤;
答案為B。


科目:高中化學 來源: 題型:
【題目】如圖所示,廣口瓶中盛有氣體X,膠頭滴管中盛有液體Y,若擠壓膠頭滴管使液體滴入瓶中,振蕩,一段時間后可見小球a膨脹鼓起。下表中的各組物質不出現上述現象的是( )

A. X為一氧化碳、Y為氫氧化鈣溶液
B. X為二氧化碳、Y為氫氧化鈉溶液
C. X為氯化氫、Y為氫氧化鋇溶液
D. X為二氧化硫、Y為氫氧化鈉溶液
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某溫度下,在一體積恒定的密閉容器內發生反應A(s)+2B(g)![]() C(g)+D(g),當下列物理量不再變化時,能夠表明反應已達平衡的是( )
C(g)+D(g),當下列物理量不再變化時,能夠表明反應已達平衡的是( )
A.氣體的壓強B.氣體的總物質的量
C.氣體的平均密度D.C和D的物質的量比是定值
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氧化鋅工業品廣泛應用于橡膠、涂料、陶瓷、化工、醫藥、玻璃和電子等行業,隨著工業的飛速發展,我國對氧化鋅的需求量日益增加,成為國民經濟建設中不可缺少的重要基礎化工原料和新型材料。用工業含鋅廢渣(主要成分為ZnO,還含有鐵、鋁、銅的氧化物,Mn2+、Pb2+、Cd2+等)制取氧化鋅的工藝流程如圖所示:
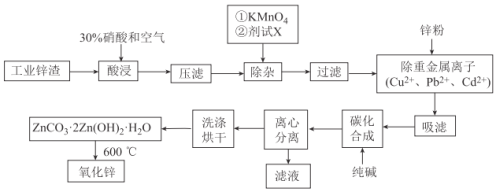
已知:相關金屬離子c(Mn+)=0.1mol/L生成氫氧化物沉淀的pH如下表所示:
Fe3+ | Fe2+ | Al3+ | Mn2+ | Zn2+ | Cu2+ | Cd2+ | |
開始沉淀 | 1.5 | 6.3 | 3.4 | 8.1 | 6.2 | 6.0 | 7.4 |
沉淀完全 | 2.8 | 8.3 | 4.7 | 10.1 | 8.2 | 8.0 | 9.4 |
回答下列問題:
(1)為保證鋅渣酸浸的充分,先保持酸過量,且c(H+)=0.5mol/L左右。寫出一種加快鋅渣浸出的方法:_______________
(2)為調節溶液的pH,則試劑X為__________________(填化學式),且調節溶液pH的范圍是____________
(3)除雜時加入高錳酸鉀的作用是_______________,發生反應的離子方程式為_____________
(4)“過濾”所得濾渣的主要成分是_____________________(填化學式)
(5)寫出“碳化合成”的化學方程式:_____________________;“碳化合成”過程需純堿稍過量,請設計實驗方案證明純堿過量:_____________________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知:甲、乙、丙、丁為常見化合物,A、B為單質,相互轉化關系如圖。其中甲是天然氣的主要成分。回答下列問題:
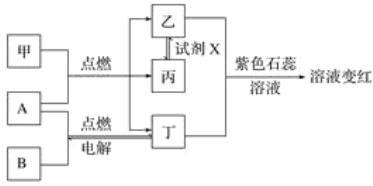
(1)丁物質的名稱:______,丙物質的化學式:_________________________________________。
(2)檢驗化合物乙的化學方程式:___________________________________________________。
(3)試劑X可能的化學式:________、________(要求:所選物質類別不同)。
(4)通過分析表明:燃料充分燃燒的條件之一是______________________________。
(5)取變紅溶液于試管中加熱,觀察到的現象有_______________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】以![]() 表示阿伏加德羅常數,下列說法中正確的是
表示阿伏加德羅常數,下列說法中正確的是
A.58.5 g氯化鈉固體中含有![]() 個氯化鈉分子
個氯化鈉分子
B.1 mol Fe參與反應失去電子數目一定為2![]()
C.1 molNa被完全氧化生成Na202,失去2![]() 個電子
個電子
D.常溫下,46 g N02和N204的混合物中含有的氮原子數為![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】隨著時代的發展,綠色環保理念越來越受到大家的認同,變廢為寶是我們每一位公民應該養成的意識。某同學嘗試用廢舊的鋁制易拉罐作為原材料、采用“氫氧化鋁法”制取明礬晶體并進行一系列的性質探究。
制取明礬晶體主要涉及到以下四個步驟:
第一步:鋁制品的溶解。取一定量鋁制品,置于250mL錐形瓶中,加入一定濃度和體積的強堿溶液,水浴加熱(約93℃),待反應完全后(不再有氫氣生成),趁熱減壓抽濾,收集濾液于250mL燒杯中;
第二步:氫氧化鋁沉淀的生成。將濾液重新置于水浴鍋中,用3 mol/L H2SO4調節濾液pH至8~9,得到不溶性白色絮凝狀Al(OH)3,減壓抽濾得到沉淀;
第三步:硫酸鋁溶液的生成。將沉淀轉移至250mL燒杯中,邊加熱邊滴入一定濃度和體積的H2SO4溶液;
第四步:硫酸鋁鉀溶液的形成。待沉淀全部溶解后加入一定量的固體K2SO4,將得到的飽和澄清溶液冷卻降溫直至晶體全部析出,減壓抽濾、洗滌、抽干,獲得產品明礬晶體[KAl(SO4)2·12H2O,M=474g/mol]。
回答下列問題:
(1)第一步鋁的溶解過程中涉及到的主要反應的離子方程式為__________________________
(2)為了加快鋁制品的溶解,應該對鋁制品進行怎樣的預處理:________________________
(3)第四步操作中,為了保證產品的純度,同時又減少產品的損失,應選擇下列溶液中的___(填選項字母)進行洗滌,實驗效果最佳。
A.乙醇 B.飽和K2SO4溶液 C.蒸餾水 D.1:1乙醇水溶液
(4)為了測定所得明礬晶體的純度,進行如下實驗操作:準確稱取明礬晶體試樣4.0g于燒杯中,加入50mL 1mol/L鹽酸進行溶解,將上述溶液轉移至100mL容量瓶中,稀釋至刻度線,搖勻;移取25.00 mL溶液干250 mL錐形瓶中,加入30 mL 0.10mol/L EDTA-2Na標準溶液,再滴加幾滴2D二甲酚橙,此時溶液呈黃色;經過后續一系列操作,最終用0.20 mol/L鋅標準溶液滴定至溶液由黃色變為紫紅色,達到滴定終點時,共消耗5.00 mL鋅標準溶液。滴定原理為H2Y2-+Al3+→AlY-+2H+,H2Y2-(過量)+Zn2+→ZnY2-+2H+(注:H2Y2-表示EDTA-2Na標準溶液離子)。則所得明礬晶體的純度為_________%。
(5)明礬除了可以用作人們熟悉的凈水劑之外,還常用作部分食品的膨松劑,例如油條(餅)的制作過程需要加入一定量的明礬,請簡述明礬在面食制作過程作膨松劑的原理:_______
(6)為了探究明礬晶體的結晶水數目及分解產物,在N2氣流中進行熱分解實驗,得到明礬晶體的熱分解曲線如圖所示(TG%代表的是分解后剩余固體質量占樣品原始質量的百分率,失重百分率=![]() ×100%):
×100%):
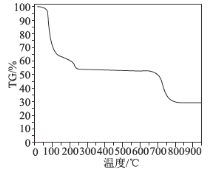
根據TG曲線出現的平臺及失重百分率,30~270℃范圍內,失重率約為45.57%,680~810℃范圍內,失重百分率約為25.31%,總失重率約為70.88%,請分別寫出所涉及到30~270℃、680~810℃溫度范圍內這兩個階段的熱分解方程式:___________、_____________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】室溫下進行下列實驗,根據實驗操作和現象所得到的結論正確的是( )
選項 | 實驗操作和現象 | 結 論 |
A | 將 | 生成了 |
B | 向濃度均為 |
|
C | 淀粉 | 還原性: |
D | 用pH試紙測得: |
|
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化學 來源: 題型:
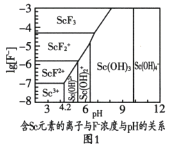
【題目】“稀土之父”徐光憲對稀土萃取分離做出了巨大貢獻。稀土是隱形戰機、超導、核工業等高精尖領域必備的原料。鈧(Sc)是稀土金屬之一,如圖是制備Sc的工藝流程。

已知:xNH4ClyScF3zH2O是ScF3與氯化物形成的復鹽沉淀,在強酸中部分溶解。“脫水除銨”是復鹽沉淀的熱分解過程。
據此回答:
(1)在空氣中焙燒Sc2(C2O4)3只生成一種碳氧化物的化學方程式為 ________。
(2)圖1是含Sc元素的離子與F-濃度和pH的關系。用氨調節溶液pH,調節3.5<pH<4.2原因是________。
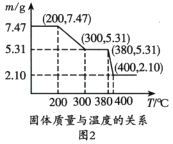
(3)圖2是“脫水除銨”過程中固體質量與溫度的關系,其中在380℃到400℃會有白煙冒出,保溫至無煙氣產生,即得到ScF3,由圖像中數據計算復鹽中x:z=________;工藝流程中可回收利用的物質是________。
(4)傳統制備ScF3的方法是先得到ScF36H2O沉淀,再高溫脫水得ScF3,但通常含有ScOF雜質,原因是________(用化學方程式表示)。流程中將復鹽沉淀后“脫水除銨”制得純度很高的SeF3,其原因是________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com