
【題目】在0.1 mol·L-1 CH3COOH溶液中存在如下電離平衡: CH3COOH ![]() CH3COO-+H+,對于該平衡,下列敘述正確的是( )
CH3COO-+H+,對于該平衡,下列敘述正確的是( )
A. 加入水時,平衡向逆反應方向移動
B. 加入少量NaOH固體,平衡向正反應方向移動
C. 加入少量0.1 mol·L-1 HCl溶液,溶液中c(H+)減小
D. 加入少量CH3COONa固體,平衡向正反應方向移動
科目:高中化學 來源: 題型:
【題目】在大試管內將足量NaHCO3加熱到 200℃,將產生的混合氣體通入到盛有1.87 g Na2O和Na2O2的密閉容器中,待Na2O和Na2O2全部反應后,得到標準狀況下224 mL O2;再將反應后密閉容器內的固體全部溶于水配成 100 mL 溶液。下列說法正確的是
A.Na2O和Na2O2 均為堿性氧化物
B.參加反應的NaHCO3物質的量為 0.04 mol
C.反應過程中總共轉移 0.04 mol 電子
D.配成的 100 mL 溶液中 c(Na+) = 0.5 mol/L
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一種實驗室制備次氯酸鈉和氯酸鉀的裝置和步驟如下:
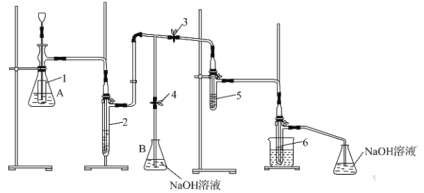
①如圖組裝裝置,檢查裝置的氣密性。②在錐形瓶A內放入5gKMnO4粉末,安全漏斗深入試管內部。在試管5中放入4mL6mol·L-1的KOH溶液,試管6中放入4mL2mol·L-1的NaOH溶液。③打開止水夾3,關閉止水夾4,控制試管5中溫度在323~328K范圍內,通過安全漏斗向錐形瓶A中緩緩加入15mL9mol·L-1的鹽酸,并控制氯氣均勻產生。④當試管5內由無色慢慢變為黃綠色,再由黃綠色突然變成無色時,繼續通氯氣至溶液呈極淡的黃色,停止加熱。⑤。⑥將試管5拆下,冷水浴冷卻至不再有晶體析出,過濾、洗滌、干燥。
回答下列問題:
(1)錐形瓶A內的小試管的作用是___。
(2)洗氣瓶2內的試劑可以是___。
A.飽和氯化鈣溶液 B.濃硫酸 C.飽和食鹽水 D.飽和碳酸氫鈉溶液
(3)控制試管5中溫度在323~328K范圍內,采取的加熱方式是___。試管5因生成了KClO而顯黃綠色,KClO的電子式為___。黃綠色突然變為無色是因為KClO分解生成了KClO3,寫出KClO分解的化學方程式:___。
(4)步驟⑤的操作是___。
(5)步驟⑥中得到的晶體用乙醇洗滌的優點是___。
(6)取試管6中的液體少許于另一試管中,加入硫酸調至弱酸性,向其中滴加0.2mol·L-1的MnSO4溶液,有黑色沉淀生成,則發生反應的離子方程式為___。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】工業上通常利用SiO2 和碳反應來制取硅,寫出反應的化學方程式___________________。
工業上還可以利用鎂制取硅,反應為2Mg+SiO2 = 2MgO+Si,同時會發生副反應:2Mg + Si = Mg2Si。如圖是進行Mg與SiO2反應的實驗裝置,試回答下列問題:

(1)由于O2和H2O(g)的存在對該實驗有較大影響,實驗中應通入氣體X作為保護氣,試管中的固體藥品可選用________(填序號)。
a.石灰石 b.鋅粒 c.純堿
(2)實驗開始時,必須先通一段時間X氣體,再加熱反應物,其理由是 ___________________________;當反應引發后,移走酒精燈,反應能繼續進行,其原因是______________________。
(3)反應結束后,待冷卻至常溫時,往反應后的混合物中加入稀鹽酸,可觀察到閃亮的火星,產生此現象的原因是副產物Mg2Si遇鹽酸迅速反應生成SiH4(硅烷)氣體,然后SiH4自燃.用化學方程式表示這兩個反應①________________________②___________________.
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】研究CO2與CH4的反應使之轉化為CO和H2,對減緩燃料危機,減少溫室效應具有重要的意義。
(1)已知CH4(g)+CO2(g)![]() 2CO(g)+2H2(g) △H=+248kJ·mol-1、△S=310J mol-1·K-1,該反應能自發進行的溫度范圍為____。
2CO(g)+2H2(g) △H=+248kJ·mol-1、△S=310J mol-1·K-1,該反應能自發進行的溫度范圍為____。
(2)在密閉恒容容器中通入物質的量濃度均為0.1 mol·L-1的CH4與CO2,在一定條件下發生反應CH4(g)+CO2(g)![]() 2CO(g)+2H2(g),測得CH4的平衡轉化率與溫度、壓強的關系如圖所示。
2CO(g)+2H2(g),測得CH4的平衡轉化率與溫度、壓強的關系如圖所示。

①工業生產時一般會選用P4和1250℃進行合成,請解釋其原因___________。
②在壓強為P3、1000℃的條件下,該反應5min時達到平衡點Y,則用CO表示該反應的速率為_____,該溫度下,反應的平衡常數為_________(保留3位有效數字)。
(3)CO和H2在工業上還可以通過反應C(s)+H2O(g) ![]() CO(g)+H2 (g)來制取
CO(g)+H2 (g)來制取
①在恒溫恒容下,如果從反應物出發建立平衡,可認定已達平衡狀態的是________。
A.體系壓強不再變化 B.H2、CO和H2O的物質的量之比為1:1:1
C.混合氣體的密度保持不變 D.混合氣體中H2O的百分含量保持不變
②在某體積可變的密閉容器中同時投入四種物質,2min時達到平衡,測得容器中有1mol H2O(g)、1mol CO(g)、2.2molH2(g)和足量的C(s),如果此時對體系加壓,平衡向__________(填“正”或“逆”)反應方向移動,達到新的平衡后,氣體的平均摩爾質量為__________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用NA表示阿伏加德羅常數的值,下列敘述中正確的是( )
A.1L0.lmol/L的Na2SiO3溶液中含陰離子總數為0.1NA個
B.0.1mol的2H37Cl分子的中子數是2.1NA
C.7.8gNa2O2與足量水充分反應轉移的電子數目為0.2NA
D.1mol雄黃(As4S4),結構如圖:![]() ,含有4NA個S-S鍵
,含有4NA個S-S鍵
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知水在25 ℃和95 ℃時的電離平衡曲線如圖所示:
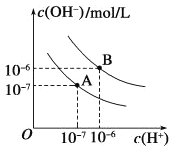
(1)25 ℃時水的電離平衡曲線應為__________ (填“A”或“B”)。
(2)95 ℃時水的離子積Kw=__________。
(3)25 ℃時,將pH=9的NaOH溶液與pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,則NaOH溶液與H2SO4溶液的體積比為_____。
(4)95 ℃時,若100 mL pH1=a的某強酸溶液與1 mL pH2=b的某強堿溶液混合后,所得溶液呈中性,則混合前,該強酸的pH1與強堿的pH2之間應滿足的關系是____________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在以下各種情形下,下列電離方程式的書寫正確的是
A.熔融狀態下的NaHSO4電離:NaHSO4=Na++H++SO42-
B.H2CO3的電離:H2CO3![]() 2H++CO32-
2H++CO32-
C.Fe(OH)3的電離:Fe(OH)3![]() Fe3++3OH-
Fe3++3OH-
D.水溶液中的NaHSO4電離:NaHSO4=Na++HSO4-
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】現在正是全球抗擊新冠病毒的關鍵時期,專家指出磷酸氯喹對治療新冠病毒感染有明顯效果,磷酸氯喹的分子結構如圖所示,下列關于該有機物的說法正確的是( )
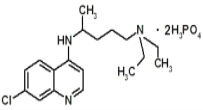
A.該有機物的分子式為:C18H30N3O8P2Cl
B.該有機物能夠發生加成反應、取代反應、不能發生氧化反應
C.該有機物苯環上的1-溴代物只有2種
D.1mol該有機物最多能和8molNaOH發生反應
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com