
【題目】利用氫氣對廢氣進行脫碳處理可實現綠色環保、廢物利用,對于減少霧霾也具有重要意義。
(1)汽車尾氣的主要污染物為NO,用H2催化還原NO可以達到消除污染的目的。
已知:2NO(g) ![]() N2(g)+O2(g) ΔH=-180.5 kJ·mol-1
N2(g)+O2(g) ΔH=-180.5 kJ·mol-1
2H2O(l)===2H2(g)+O2(g) ΔH=+571.6 kJ·mol-1
寫出H2(g)與NO(g)反應生成N2(g)和H2O(l)的熱化學方程式是______________。
(2)某研究小組模擬研究如下:向2 L恒容密閉容器中充入2 mol NO發生反應2NO(g) ![]() N2(g)+O2(g),在不同的溫度下,反應過程中物質的量與時間的關系如圖所示:
N2(g)+O2(g),在不同的溫度下,反應過程中物質的量與時間的關系如圖所示:
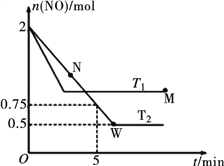
①T2下,在0~5 min內,v(O2)=______________mol·L-1·min-1;該溫度下反應N2(g)+O2(g) ![]() 2NO(g)的平衡常數K=______________。
2NO(g)的平衡常數K=______________。
②該反應進行到M點放出的熱量______________進行到W點放出的熱量(填“>”、“<”或“=”)。
M點時再加入一定量NO,平衡后NO的轉化率______________(填“變大”、“變小”或“不變”)。
③反應開始至達到平衡的過程中,容器中下列各項發生變化的是______________(填序號)。
a.混合氣體的密度 b.逆反應速率
c.單位時間內,N2和NO的消耗量之比 d.氣體的平均相對分子質量
(3)氫氣作為一種理想燃料,但不利于貯存和運輸。利用氫能需要選擇合適的儲氫材料,鑭鎳合金在一定條件下可吸收氫氣形成氫化物:LaNi5(s)+3H2(g) ![]() LaNi5H6(s) ΔH<0,欲使LaNi5H6(s)釋放出氣態氫,根據平衡移動原理,可改變的條件是______________(填字母編號)。
LaNi5H6(s) ΔH<0,欲使LaNi5H6(s)釋放出氣態氫,根據平衡移動原理,可改變的條件是______________(填字母編號)。
A.增加LaNi5H6(s)的量 B.升高溫度
C.使用催化劑 D.減小壓強
【答案】2H2(g)+2NO(g)===N2(g)+2H2O(l) ΔH=-752.1 kJ·mol-1 6.25×10-2 ![]() 或 0.44 < 不變 bc BD
或 0.44 < 不變 bc BD
【解析】
試題本題主要考查熱化學方程式的書寫,化學平衡圖像的分析,化學反應速率和化學平衡常數的計算,外界條件對化學平衡的影響。
(1)將反應編號:2NO(g)![]() N2(g)+O2(g)ΔH=-180.5 kJ·mol-1(①式)
N2(g)+O2(g)ΔH=-180.5 kJ·mol-1(①式)
2H2O(l)=2H2(g)+O2(g)ΔH=+571.6 kJ·mol-1(②式)
應用蓋斯定律,①式-②式得2H2(g)+2NO(g)=N2(g)+2H2O(l)ΔH=(-180.5kJ/mol)-(+571.6kJ/mol)=-752.1kJ/mol,H2(g)與NO(g)反應生成N2(g)和H2O(l)的熱化學方程式為2H2(g)+2NO(g)=N2(g)+2H2O(l)ΔH=-752.1kJ/mol。
(2)①T2下在0~5min內,υ(NO)=![]() =
=![]() =0.125mol/(L·min),則υ(O2)=
=0.125mol/(L·min),則υ(O2)=![]() υ(NO)=0.0625mol/(L·min)。由圖像可見該溫度下達到平衡時n(NO)=0.5mol,用三段式
υ(NO)=0.0625mol/(L·min)。由圖像可見該溫度下達到平衡時n(NO)=0.5mol,用三段式
2NO(g)![]() N2(g)+O2(g)
N2(g)+O2(g)
n(起始)(mol) 2 0 0
n(轉化)(mol) 1.5 0.75 0.75
n(平衡)(mol) 0.5 0.75 0.75
平衡時NO、N2、O2物質的量濃度依次為0.25mol/L、0.375mol/L、0.375mol/L,反應的平衡常數=![]() =
=![]() =
=![]() ,則反應N2(g)+O2(g)
,則反應N2(g)+O2(g)![]() 2NO(g)的平衡常數K=
2NO(g)的平衡常數K=![]() =
=![]() =0.44。
=0.44。
②反應進行到M點轉化NO物質的量小于反應進行到W點轉化NO物質的量,反應進行到M點放出的熱量![]() 進行到W點放出的熱量。M點時再加入一定量NO,平衡向正反應方向移動,加入NO相當于增大壓強(增大壓強平衡不移動),平衡后NO的轉化率不變。
進行到W點放出的熱量。M點時再加入一定量NO,平衡向正反應方向移動,加入NO相當于增大壓強(增大壓強平衡不移動),平衡后NO的轉化率不變。
③a,該反應中所有物質都呈氣態,根據質量守恒定律,氣體的總質量始終不變,容器容積不變,混合氣體的密度始終不變;b,反應開始逆反應速率為0,反應開始至達到平衡過程中逆反應速率增大,達平衡時逆反應速率不變;c,單位時間內N2的消耗量表示逆反應速率,單位時間內NO的消耗量表示正反應速率,從反應開始至達到平衡的過程中,逆反應速率增大,正反應速率減小,單位時間內N2和NO的消耗量之比增大;d,該反應中所有物質都呈氣態,根據質量守恒定律,氣體的總質量始終不變,該反應反應前后氣體分子數不變,氣體分子物質的量始終不變,氣體的平均相對分子質量始終不變;從開始至達到平衡的過程,發生變化的是bc,答案選bc。
(3)A,增加LaNi5H6(s)的量,平衡不移動,不會釋放出氣態氫;B,正反應為放熱反應,升高溫度平衡向逆反應方向移動,釋放出氣態氫;C,使用催化劑,平衡不移動,不會釋放出氣態氫;D,減小壓強,平衡向逆反應方向移動,釋放出氣態氫;使LaNi5H6(s)釋放出氣態氫,可改變的條件是升高溫度、減小壓強,答案選BD。


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
【題目】下列關于苯的敘述正確的是( )
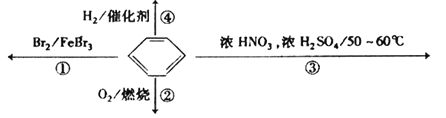
A. 反應![]() 為取代反應,有機產物的密度比水小
為取代反應,有機產物的密度比水小
B. 反應![]() 為取代反應,有機產物是一種烴
為取代反應,有機產物是一種烴
C. 反應![]() 中1mol苯最多與
中1mol苯最多與![]() 發生加成反應,是因為苯分子含有三個碳碳雙鍵
發生加成反應,是因為苯分子含有三個碳碳雙鍵
D. 反應![]() 為氧化反應,反應現象是火焰明亮并帶有較多的黑煙
為氧化反應,反應現象是火焰明亮并帶有較多的黑煙
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】N0表示阿伏加德羅常數的值,下列說法正確的是
A. 1g H2所含分子數為N0
B. 2g D2O中所含的質子數為N0
C. 0.5 mol/L Na2SO4溶液中所含Na+ 數為N0
D. 標準狀況下,4.48 L CCl4所含原子數為N0
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】“氫能”是未來最理想的新能源。
(1)實驗測得,1 g氫氣燃燒生成液態水時放出142.9 kJ熱量,則氫氣燃燒的熱化學方程式為_____。(填序號)
A.2H2(g)+O2(g)=2H2O(l) ΔH =-142.9 kJ·mol1
B.H2(g)+1/2O2(g)=H2O(l) ΔH=-285.8 kJ·mol1
C.2H2+O2=2H2O(l) ΔH= 571.6 kJ·mol1
D.H2(g)+1/2O2(g)=H2O(g) ΔH=-285.8 kJ·mol1
(2)某化學家根據“原子經濟”的思想,設計了如下制備H2的反應步驟:
① CaBr2+H2O![]() CaO+2HBr
CaO+2HBr
② 2HBr+Hg![]() HgBr2+H2↑
HgBr2+H2↑
③ HgBr2+_______![]() ________
________
④ 2HgO![]() 2Hg+O2↑
2Hg+O2↑
⑤2H2+O2![]() 2H2O
2H2O
請你根據“原子經濟”的思想完成上述步驟③的化學方程式:___________。并根據“綠色化學”的思想評估該方法制H2的主要缺點_________。
(3)利用核能把水分解制氫氣,是目前正在研究的課題。如圖是其中的一種流程,其中用了過量的碘。
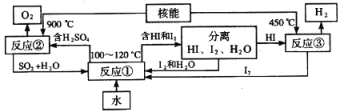
完成下列反應的化學方程式:反應①______________;反應②____________。此法制取氫氣的最大優點是______________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】城市使用的燃料,現大多用煤氣、液化石油氣。煤氣的主要成分是一氧化碳和氫氣的混合氣,它由煤炭與水(蒸氣)反應制得,故又稱水煤氣。
(1)試寫出制取水煤氣的主要化學方程式___________________。
(2)液化石油氣的主要成分是丙烷,丙烷燃燒的熱化學方程式為:C3H8(g)+5O2(g)=3CO2(g)+4H2O(l) ΔH=-2 220.0 kJmol1。已知CO氣體燃燒的熱化學方程式為:CO(g)+1/2O2(g)=CO2(g) ΔH=-283.0 kJmol1。試比較相同物質的量的C3H8和CO燃燒,產生的熱量比值約為_________。
(3)已知氫氣燃燒的熱化學方程式為:2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJmol1。試比較同質量的氫氣和丙烷燃燒,產生的熱量比值約為______。
(4)氫氣是未來的能源,除產生的熱量大之外,還具有的優點是___________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在鋁與稀硫酸的反應中,已知10s末硫酸的濃度減少了0.6 mol/L,不考慮反應過程中溶液體積的變化,則10s內生成硫酸鋁的平均反應速率是( )
A. 0.02 mol/(Lmin)B. 1.2 mol/(Lmin)
C. 1.8mol/(Lmin)D. 0.18 mol/(Lmin)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知:HCN(aq)與NaOH(aq)反應的ΔH=-12.1 kJ·mol-1;HCl(aq)與NaOH(aq)反應的ΔH=-55.6 kJ·mol-1,則HCN在水溶液中電離的ΔH等于
A. -67.7 kJ·mol-1 B. -43.5 kJ·mol-1 C. +43.5 kJ·mol-1 D. +67.7 kJ·mol-1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氯原子對O3分解有催化作用:
O3+Cl===ClO+O2 ΔH1
ClO+O===Cl+O2 ΔH2
大氣臭氧層的分解反應是:O3+O===2O2 ΔH,該反應的能量變化如圖:

下列敘述中,正確的是
A. 反應O3+O===2O2的ΔH=E1-E3
B. O3+O===2O2是吸熱反應
C. ΔH=ΔH1+ΔH2
D. ΔH=E3-E2>0
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com