
【題目】下列有關晶體的敘述不正確的是( )
A.氯化鈉和氯化銫晶體中,陰離子的配位數均為6
B.金剛石為空間網狀結構,由碳原子以sp3雜化軌道形成共價鍵
C.金屬鈉的晶體采用體心立方堆積,每個晶胞含2個原子,配位數為8
D.干冰晶體中,每個CO2分子周圍緊鄰12個CO2分子
 智趣暑假溫故知新系列答案
智趣暑假溫故知新系列答案 英語小英雄天天默寫系列答案
英語小英雄天天默寫系列答案科目:高中化學 來源: 題型:
【題目】某化學小組同學在學習Cl2的實驗室制法后,發現用加熱濃鹽酸與MnO2合物的方法制Cl2既浪費能源又不易控制溫度,他們現欲對該實驗進行改進并驗證Cl2的部分性質,進行了如下探究活動。
查閱資料:KMnO4和KClO3的氧化性都比MnO2強,在不加熱的條件下均可與濃鹽酸發生反應,從而實現制取Cl2的目的。
(1)確定反應原理:![]() __________________
__________________![]()
(2)選擇實驗裝置:現有如圖所示的裝置,可以選擇其中的__________________(填序號)進行實驗。

(3)裝置的正確連接順序為__________________(用小寫字母序號表示)。
(4)①實驗時C中所裝液體是__________________。
②在制氯氣前,必須進行的一項操作是__________________。
③D中所裝液體是__________________。
(5)將產生的氯氣通入滴有酚酞的NaOH溶液中,溶液紅色退去。小組內有甲、乙兩種意見。
甲:氯氣溶于水后溶液顯酸性,中和了NaOH,使溶液退色。
乙:氯氣溶于水生成漂白性物質,使溶液退色。
某同學在退色后的溶液中逐漸加入足量的NaOH溶液,溶液一直未顯紅色,說明_________(填“甲”或“乙”)正確。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某同學設計如圖裝置,用過量濃硫酸與銅反應制取SO2,并探究SO2與Na2O2反應的產物。

Ⅰ.制取SO2
(1)寫出燒瓶中生成SO2的化學方程式:_______________________。
(2)寫出實驗現象:
①細銅絲表面:_______________________________________。
②實驗過程中,燒瓶內液體始終保持澄清,并_______________________________。
(3)欲使反應停止,應進行的操作是:______________________________________。
燒瓶中液體冷卻后,可觀察到的現象是:___________________________________。
Ⅱ.探究SO2與Na2O2反應后的固體產物。
(4)實驗方案如下:取洗滌玻璃棉所得溶液,________________________________
(5)把Na2O2粉末散附在玻璃棉上的目的是:__________________________________。
若Na2O2未完全反應,對實驗結果的影響是(用必要的文字和化學方程式表示)_______________________________________________________________________
III.裝置改進
(6)老師指出該實驗裝置需做如下改進(只答出一種即可):
___________________________________________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】通常情況下,NCl3是一種油狀液體,其分子空間構型與NH3相似,下列對NCl3和NH3的有關敘述正確的是( )
A. 分子中N—Cl鍵鍵長與CCl4分子中C—Cl鍵鍵長相等
B. 在氨水中,大部分NH3與H2O以氫鍵(用“…”表示)結合形成NH3·H2O分子,則NH3·H2O的結構式為: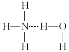
C. NCl3分子是非極性分子
D. NBr3比NCl3易揮發
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】以黃鐵礦(主要成分為FeS2)為原料制備氯化鐵晶體(FeCl3·6H2O)的工藝流程如下:
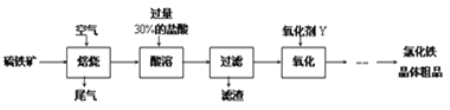
請按要求回答下列問題:
(1)需將硫鐵礦粉碎再焙燒的目的是______________________________________.
(2)酸溶及后續過程中均需保持鹽酸過量,其目的是_____________、__________.
(3)尾氣主要含N2、O2、SO2和少量的CO2、H2O(g).測定尾氣中SO2含量的方案如下:
(方案甲)將標準狀況下的2.24 L尾氣緩慢通過如下裝置A中:
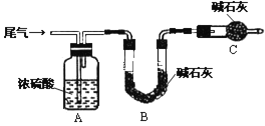
①C儀器的名稱是_______________,裝置C的作用是_________________________.
②實驗時先通入尾氣,再通入一定量氮氣,通過B裝置的增重來測量SO2的體積分數,請寫出該方案合理與否的理由__________________________________________.
(方案乙)將標準狀況下的2.24 L尾氣緩慢通過如下裝置D中,充分與足量試劑M反應后,再滴入過量試劑N,經過濾、洗滌、干燥、用電子天平稱得沉淀質量為0.233g.
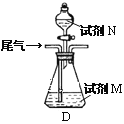
③若試劑M、N分別是碘水、BaCl2溶液,寫出D中總反應的離子方程式: __________________.尾氣中SO2的體積分數為__________________.
④若試劑M是Ba(NO3)2溶液,不再滴加試劑N,觀察到D中生成的無色氣體在瓶口處變為紅棕色.寫出SO2和Ba(NO3)2溶液反應的離子方程式:___________________________.
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】堿式碳酸鎂![]() 是重要的無機化工產品。一種由白云石
是重要的無機化工產品。一種由白云石![]() 主要成分為
主要成分為![]() ,還含少量
,還含少量![]() 、
、![]() 等
等![]() 為原料制備堿式碳酸鎂
為原料制備堿式碳酸鎂![]() 國家標準中CaO的質量分數
國家標準中CaO的質量分數![]()
![]() 的實驗流程如下:
的實驗流程如下:

![]() “煅燒”時發生主要反應的化學方程式為________________。
“煅燒”時發生主要反應的化學方程式為________________。
![]() 常溫常壓下“碳化”可使鎂元素轉化為
常溫常壓下“碳化”可使鎂元素轉化為![]() ,“碳化”時終點pH對最終產品中CaO含量及堿式碳酸鎂產率的影響如圖1和圖2所示。
,“碳化”時終點pH對最終產品中CaO含量及堿式碳酸鎂產率的影響如圖1和圖2所示。
圖1 CaO含量與碳化終點pH的關系
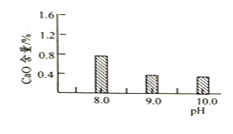
圖2堿式碳酸鎂產率與碳化終點pH的關系
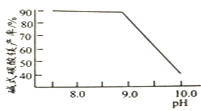
![]() 應控制“碳化”終點PH約為__________。
應控制“碳化”終點PH約為__________。
![]() 圖
圖![]() 中,當
中,當![]()
![]() 時,鎂元素的主要存在形式是__________________
時,鎂元素的主要存在形式是__________________![]() 寫化學式
寫化學式![]() 。
。
![]() “過濾”時須用到的玻璃儀器有:燒杯、玻璃棒、__________________。
“過濾”時須用到的玻璃儀器有:燒杯、玻璃棒、__________________。
![]() 一種測定堿式碳酸鎂img src="http://thumb.zyjl.cn/questionBank/Upload/2020/11/27/00/64e4569f/SYS202011270030549119707263_ST/SYS202011270030549119707263_ST.001.png" width="188" height="27" style="-aw-left-pos:0pt; -aw-rel-hpos:column; -aw-rel-vpos:paragraph; -aw-top-pos:0pt; -aw-wrap-type:inline" />組成的方法如下:
一種測定堿式碳酸鎂img src="http://thumb.zyjl.cn/questionBank/Upload/2020/11/27/00/64e4569f/SYS202011270030549119707263_ST/SYS202011270030549119707263_ST.001.png" width="188" height="27" style="-aw-left-pos:0pt; -aw-rel-hpos:column; -aw-rel-vpos:paragraph; -aw-top-pos:0pt; -aw-wrap-type:inline" />組成的方法如下:
![]() 稱取一定量的堿式碳酸鎂晶體溶于足量的鹽酸,收集到氣體
稱取一定量的堿式碳酸鎂晶體溶于足量的鹽酸,收集到氣體![]() 標準狀況
標準狀況![]() ;往所得溶液中加入足量的NaOH溶液,過濾,將所得沉淀洗滌、干燥,稱量得固體
;往所得溶液中加入足量的NaOH溶液,過濾,將所得沉淀洗滌、干燥,稱量得固體![]() 。
。
![]() 另取一定量的堿式碳酸鎂晶體在空氣中加熱,固體殘留率
另取一定量的堿式碳酸鎂晶體在空氣中加熱,固體殘留率![]() 固體樣品的剩余質量
固體樣品的剩余質量![]() 固體樣品的起始質量
固體樣品的起始質量![]() 隨溫度的變化如下圖所示
隨溫度的變化如下圖所示![]() 樣品在
樣品在![]() 時完全失去結晶水
時完全失去結晶水![]() 。
。
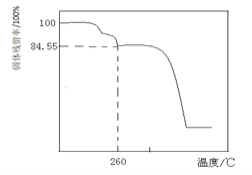
根據以上實驗數據計算確定堿式碳酸鎂晶體的化學式![]() 寫出計算過程
寫出計算過程![]() _________。
_________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】錳的合金及其化合物在現代生產、生活中有著廣泛的應用。如二氧化錳是重要的氧化劑、催化劑、干電池中的去極劑;硫酸錳是重要的微量元素肥料。
Ⅰ.某工廠以菱錳礦(MnCO3)[含FeCO3、SiO2、Cu2(OH)2CO3等雜質]為原料聯合生產二氧化錳、硫酸錳晶體的工藝流程如下圖所示:
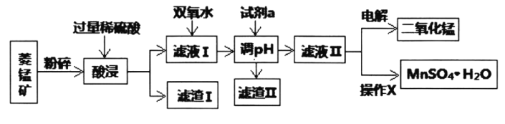
常溫下幾種金屬氧化物沉淀時的pH:
Mn(OH)2 | Fe(OH)3 | Cu(OH)2 | |
開始沉淀時的pH | 7.2 | 2.7 | 4.7 |
完全沉淀時的pH | x | 3.7 | 6.7 |
(1)該工廠調pH時,選擇試劑a的成分最好是________,濾渣Ⅱ的成分是________,操作X是________、洗滌、低溫烘干。
(2)為確保除盡雜質而又不損失錳,pH調整的范圍為________;若常溫下離子(X)沉淀完全的標準是c(X)<1.0×10-5mol/L,Ksp[Mn(OH)2]=1.0×10-13,則使Mn2+完全沉淀時溶液的pH最小為________。
(3)若濾液Ⅱ顯酸性,請寫出電解法制備MnO2時陽極上的電極反應式:________。
Ⅱ.50.7g MnSO4·H2O樣品受熱分解過程的熱重曲線(樣品質量隨溫度變化曲線)如下圖所示。(已知:M(Mn)=55g/mol)
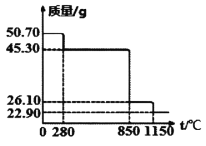
(1)850℃時,所得固體的化學式為:________________________。
(2)1150℃時,反應的化學方程式為:________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】化學興趣小組對某品牌牙膏中的摩擦劑成分及其含量進行以下探究:查得資料:該牙膏摩擦劑由碳酸鈣、氫氧化鋁組成;牙膏中其它成分遇到鹽酸時無氣體產生。
Ⅰ.摩擦劑中氫氧化鋁的定性檢驗
取適量牙膏樣品,加水充足攪拌、過濾。
(1)往濾渣中加入過量 NaOH溶液,過濾。氫氧化鋁與NaOH溶液反應的離子方程式是______。
(2)往(1)所得濾液中先通入過量二氧化碳,再加入過量稀鹽酸。觀察的現象是__________。
Ⅱ.牙膏樣品中碳酸鈣的定量測定
利用下圖所示裝置(圖中夾持儀器略去)進行實驗,充分反應后,測定C中生成的BaCO沉淀質量,以確定碳酸鈣的質量分數。
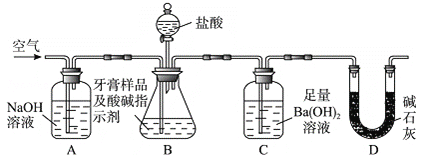
依據實驗過程回答下列問題:
(3)實驗過程中需持續緩緩通入空氣。其作用除了可攪拌B、C中的反應物外,還有:________________________________。
(4)C中反應生成沉淀的離子方程式是______________________________。
(5)下列各項措施中,不能提高測定準確度的是____________(填標號)。
a.在加入鹽酸之前,應排凈裝置內的CO2氣體 b.滴加鹽酸不宜過快
c.在A-B之間增添盛有濃硫酸的洗氣裝置
d.在B-C之間增添盛有飽和碳酸氫鈉溶液的洗氣裝置
(6)實驗中準確稱取10.00 g樣品三份,進行三次測定,測得BaCO3平均質量為3.94 g。則樣品中碳酸鈣的質量分數為__________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】現有反應:CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH=-43kJ/mol,在850℃時,K=1,今在某密閉容器中充入1.0molCO、3.0molH2O、1.0molCO2、xmolH2,下列說法不正確的是( )
CO2(g)+H2(g) ΔH=-43kJ/mol,在850℃時,K=1,今在某密閉容器中充入1.0molCO、3.0molH2O、1.0molCO2、xmolH2,下列說法不正確的是( )
A.900℃,該反應的平衡常數K<1
B.850℃達到平衡時,通入CO,CO轉化率將增大
C.850℃時,若x=5.0,則起始時平衡向逆反應方向移動
D.850℃時,若要使上述反應開始時向正反應方向進行,則![]() 應滿足0≤x<3
應滿足0≤x<3
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com