
(9分)生產生活中廣泛涉及氧化還原反應。
(1)工業上冶煉下列物質通常不采用電解法的是???????? 。
a.Na???????? b.Mg???????? c.Fe???????? d.Ag
(2)下圖為電解精煉銅的示意圖,電極a為粗銅,則a連接電源的 ????? 極,b極的電極反應式為?????????????????????? 。

(3)汽車劇烈碰撞時,安全氣囊中發生反應NaN3 + KNO3 → K2O + Na2O + X↑(未配平),已知X為單質,在反應中NaN3失去電子。則該反應的氧化劑為??????????????? ,X的化學式為???????? ,該反應的氧化劑和還原劑的物質的量之比為?????????? 。
(4)工業上制取高純度MnO2的某一步驟如圖所示,請寫出該反應的離子方程式?????????????????? 。

(1)cd (2分)
(2)正 (1分) Cu2++2e?=Cu (1分)
(3)KNO3? N2?? 1:5? (共3分,各1分)
(4)5Mn2+ + 2ClO3? + 4H2O = 5MnO2↓+ Cl2↑+ 8H+? (2分)
【解析】
試題分析:(1)Na、Mg為活潑金屬,無法用還原劑還原化合物制取金屬單質,Fe可用還原劑還原化合物制取金屬單質,Ag可用加熱Ag2O的方法制取Ag,故cd項正確。
(2)電解精煉銅,粗銅為陽極,連接在電源的正極;b極為陰極,電解質溶液中的Cu2+在陰極上得電子,電解方程式為:Cu2++2e?=Cu。
(3)已知X為單質,在反應中NaN3失去電子,可推出X為N2,KNO3中N元素化合價降低,在反應中得電子,所以KNO3為氧化劑;根據氧化反應中氧化劑所得電子總數與還原劑失去電子總數相等,可得n(NaN3)=5n(KNO3),所以氧化劑和還原劑的物質的量之比,即n(KNO3):n(NaN3)=1:5.
(4)根據圖示可知,ClO3?把Mn2+氧化為MnO2,可得離子方程式為:5Mn2+ + 2ClO3? + 4H2O = 5MnO2↓+ Cl2↑+ 8H+
考點:本題考查金屬的冶煉、電解精煉銅、氧化還原反應原理及應用、離子方程式的書寫。


 發散思維新課堂系列答案
發散思維新課堂系列答案科目:高中化學 來源: 題型:閱讀理解
| O | 2- 7 |
| O | 2- 4 |
| O | 2- 7 |

| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| pH | 5.2 | 3.2 | 9.7 | 6.7 |
查看答案和解析>>
科目:高中化學 來源:2013-2014學年北京市延慶縣高三第一次模擬理綜化學試卷(解析版) 題型:選擇題
原電池與電解池在生活和生產中有著廣泛應用。下列有關判斷中錯誤的是
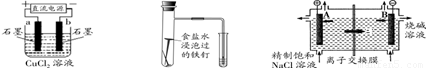
裝置① 裝置② 裝置③
A.裝置①研究的是電解CuCl2溶液,b電極上有紅色固體析出
B.裝置②研究的是金屬的吸氧腐蝕,Fe上的反應為Fe-2e- = Fe2+
C.裝置③研究的是電解飽和食鹽水, B電極發生的反應:2Cl--2e- = Cl2↑
D.三個裝置中涉及的主要反應都是氧化還原反應
查看答案和解析>>
科目:高中化學 來源:2012-2013學年北京市通州區高三年級上學期期末摸底考試化學試卷(解析版) 題型:選擇題
原電池與電解池在生活和生產中有著廣泛應用。下列有關判斷中錯誤的是

裝置① 裝置② 裝置③
A.裝置①研究的是金屬的吸氧腐蝕,Fe上的反應為Fe-2e = Fe2+
B.裝置②研究的是電解CuCl2溶液,它將電能轉化為化學能
C.裝置③研究的是電解飽和食鹽水,電解過程中,B極上發生氧化反應
D.三個裝置中涉及的主要反應都是氧化還原反應
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 ______Cu2+______Fe2++______H++______S
______Cu2+______Fe2++______H++______S
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com