
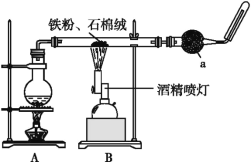
【題目】如圖是鐵與水蒸氣反應的實驗裝置。在硬質玻璃管中放入還原鐵粉和石棉絨(石棉絨是耐高溫材料,與水、鐵不反應)的混合物,加熱,并通入水蒸氣,就可以完成高溫下鐵與水蒸氣反應的實驗。
(1)已知該實驗反應的反應方程式為:Fe+H2O![]() Fe3O4+H2(請配平)____。
Fe3O4+H2(請配平)____。
(2)儀器a的名稱是________。
(3)某同學為了研究一定時間內鐵粉的轉化率,設計了如下實驗:準確稱量一定質量的鐵粉進行反應,測量反應后生成氣體的體積,計算鐵粉的轉化率。
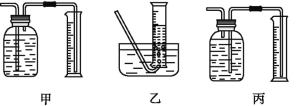
①該同學應該先點燃___(填“A”或“B”)處的酒精燈(或酒精噴燈),測量氣體體積不可以選用上圖中___(填“甲”“乙”或“丙”)裝置。
②稱取5.6 g鐵粉與適量石棉絨混合,然后加熱反應一段時間。若測出的氣體體積在標準狀況下為0.448 L,則鐵粉的轉化率為___。
(4)將硬質玻璃管中反應后的固體混合物全部取出置于燒杯中,加入足量的鹽酸溶解并過濾,為探究反應后溶液中可能的陽離子,小林同學進行如下實驗,請你將下表補充完整:
步驟 | 現象 | 解釋(用離子方程式表示) | 結論 |
Ⅰ.取樣,滴加KSCN溶液 | 溶液不變紅色 | ①Fe3O4+8H+=Fe2++2Fe3++4H2O ②____________ | Ⅲ.反應后的溶液中陽離子為_______ |
Ⅱ.取樣,滴加NaOH溶液 | 剛開始無明顯現象,一段時間后先出現白色沉淀,迅速變為灰綠色,最終變為紅褐色 | ①____________ ②Fe2++2OH—=Fe(OH)2↓ ③4Fe(OH)2+2H2O+O2=4Fe(OH)3 |
【答案】3、4、1、4 干燥管 A 甲 15% Fe+2Fe3+=3Fe2+ OH-+H+=H2O H+、Fe2+
【解析】
(1)根據原子守恒配平反應的方程式;
(2)分析裝置圖中儀器形狀和用途判斷儀器名稱;
(3)①高溫鐵和水蒸氣反應,所以裝置A處加熱產生水蒸氣,再點燃B裝置處的酒精燈,根據儀器的構造特點分析判斷;
②依據鐵和水蒸氣反應生成四氧化三鐵和氫氣,依據反應化學方程式定量關系計算反應的鐵的質量,得到鐵的轉化率;
(4)依據方程式和實驗現象分析判斷。
(1)根據原子守恒可知該反應的化學方程式為3Fe+4H2O(g)![]() Fe3O4+4H2;
Fe3O4+4H2;
(2)根據裝置圖中儀器的構造可知儀器a的名稱是干燥管;
(3)①高溫鐵和水蒸氣反應,所以裝置A處加熱產生水蒸氣,再點燃B裝置處的酒精燈,甲中導氣管位置錯誤,不能到達排水量氣的目的,不可以測量生成氫氣的體積,乙丙都可以利用裝置測定生成氣體的體積;
②稱取5.6 g鐵粉與適量石棉絨混合,然后加熱反應一段時間。若測出的氣體體積在標準狀況下為0.448 L,生成的氣體是氫氣,物質的量為0.02mol,依據反應的化學方程式得到反應鐵的質量為0.02mol×![]() =0.015mol,質量是0.015mol×56g/mol=0.84g,則鐵粉的轉化率為
=0.015mol,質量是0.015mol×56g/mol=0.84g,則鐵粉的轉化率為![]() ×100%=15%;
×100%=15%;
(4)向反應后的溶液中滴加KSCN溶液,溶液不變紅色,溶液中不存在鐵離子,這說明鐵過量,生成的鐵離子被鐵還原生成亞鐵離子,離子方程式為Fe+2Fe3+=3Fe2+;取樣,滴加NaOH溶液,剛開始無明顯現象,說明鹽酸過量,首先發生中和反應,方程式為OH—+H+=H2O;根據離子方程式可知有氫氧化亞鐵生成,又因為氫氧化亞鐵易被氧化,所以實驗現象是一段時間后先出現白色沉淀,迅速變為灰綠色,最終變為紅褐色,根據以上分析可知反應后的溶液中陽離子為H+、Fe2+。


 怎樣學好牛津英語系列答案
怎樣學好牛津英語系列答案 導學教程高中新課標系列答案
導學教程高中新課標系列答案科目:高中化學 來源: 題型:
【題目】某研究性學習小組將下列裝置如圖連接,E、F、X、Y都是惰性電極。將電源接通后,向乙中滴入酚酞試液,在F極附近顯紅色。試回答下列問題:

(1)電源A極的名稱是____,丁中____(填“X”或“Y”)極顏色會加深。
(2)欲用丙裝置給銅鍍銀,H應該是____,電鍍液的主要成分是____(填化學式)。
(3)如果收集乙裝置中產生的氣體,相同條件下兩種氣體的體積比是___。
(4)甲裝置為使用過的鉛蓄電池,充電后電極D應與用電器的____(填“正”或“負”)極連接,電極C上的電極反應式為____。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】改變0.1mol·L-1二元弱酸H2A溶液的pH,溶液中的H2A、HA-、A2-的物質的量分數φ(X)隨pH的變化如圖所示。

下列敘述錯誤的是( )
A.pH=1.2時,c(H2A)=c(HA-)
B.lg[K2(H2A)]=-4.2
C.pH=2.7時,c(HA-)>c(H2A)=c(A2-)
D.pH=4.2時,c(HA-)=c(A2-)=c(H+)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知X為一種常見酸的濃溶液,能使蔗糖粉末變黑。A與X反應的轉化關系如圖所示,其中反應條件及部分產物均已略去,則下列有關說法正確的是
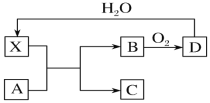
A.X使蔗糖變黑的現象主要體現了X的強氧化性
B.若A為鐵,則足量A與X在室溫下即可完全反應
C.工業上,B轉化為D的反應條件為高溫、常壓、使用催化劑
D.若A為碳單質,則將C通入少量的澄清石灰水,一定可以觀察到有白色沉淀產生
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】現有X、Y、Z、T四種短周期元素,原子序數依次增大。請根據下列相關信息,回答問題。
元素 | 相關信息 |
X | 原子的1s軌道上只有1個電子 |
Y | 原子的L層上s電子數等于p電子數 |
Z | 空氣中含其單質,原子的最外層未成對電子數是該元素所在周期中最多的 |
T | 負二價的元素T的氫化物在通常情況下是一種液體,且T的質量分數為88.9% |
(1) Z2X4分子中Z原子采取________雜化,寫出與之互為等電子體的有機物的結構簡式_____________________
(2) Cl2T分子的空間構型___________, Z2T的電子式_________________
(3) 請用價層電子對互斥理論解釋ZX![]() 和ZX3的鍵角∠XZX的大小:_____________。
和ZX3的鍵角∠XZX的大小:_____________。
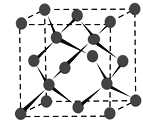
(4) Y晶體的晶胞如圖所示,該晶胞含有______個Y原子,若晶胞的密度為d g·cm-3,阿伏加德羅常數的值為NA(mol-1),則晶胞參數為a=_______ pm。(用含d 、NA的式子表示)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】借助太陽能將光解水制H2與脫硫結合起來,既能大幅度提高光解水制H2的效率,又能脫除SO2,工作原理如下圖所示。下列說法不正確的是
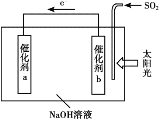
A. 該裝置可將太陽能轉化為化學能
B. 催化劑b附近的溶液pH增大
C. 吸收1mol SO2,理論上能產生1mol H2
D. 催化劑a表面發生的反應為:2H2O+2e-=H2↑+2OH-
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】硫酸是重要的化工原料,工業制取硫酸最重要的一步反應為:2SO2(g)+O2(g) ![]() 2SO3(g) △H< 0
2SO3(g) △H< 0
(1)為提高SO2的轉化率,可通入過量O2,用平衡移動原理解釋其原因:___________。
(2)某興趣小組在實驗室對該反應進行研究,部分實驗數據和圖像如下。
反應條件:催化劑、一定溫度、容積10 L
實驗 | 起始物質的量/mol | 平衡時SO3 物質的量/mol | ||
SO2 | O2 | SO3 | ||
ⅰ | 0.2 | 0.1 | 0 | 0.12 |
ⅱ | 0 | 0 | 0.2 | a |
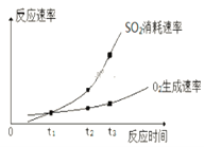
①實驗ⅰ中SO2的轉化率為______。
②a____0.12(填“>”、“=”或“<”)。
③t1、t2、t3中,達到化學平衡狀態的是________。
④ t2到t3的變化是因為改變了一個反應條件,該條件可能是___________。
(3)將SO2和O2充入恒壓密閉容器中,原料氣中SO2 和O2的物質的量之比m(m=n(SO2)/n(O2))不同時,SO2的平衡轉化率與溫度(T)的關系如下圖所示,則m1、m2、m3的大小順序為_____。
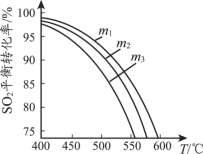
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】為提升電池循環效率和穩定性,科學家近期利用三維多孔海綿狀Zn(3DZn)可以高效沉積ZnO的特點,設計了采用強堿性電解質的3DZn—NiOOH二次電池,結構如下圖所示。電池反應為Zn(s)+2NiOOH(s)+H2O(l)![]() ZnO(s)+2Ni(OH)2(s)。
ZnO(s)+2Ni(OH)2(s)。

A. 三維多孔海綿狀Zn具有較高的表面積,所沉積的ZnO分散度高
B. 充電時陽極反應為Ni(OH)2(s)+OH(aq)e![]() NiOOH(s)+H2O(l)
NiOOH(s)+H2O(l)
C. 放電時負極反應為Zn(s)+2OH(aq)2e![]() ZnO(s)+H2O(l)
ZnO(s)+H2O(l)
D. 放電過程中OH通過隔膜從負極區移向正極區
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某新型二次電池反應原理為M+3Cn(MCl4)+4MC14-![]() 4M2C17-+3Cn(M代表金屬,Cn代表石墨)。裝置如圖所示。下列說法正確的是
4M2C17-+3Cn(M代表金屬,Cn代表石墨)。裝置如圖所示。下列說法正確的是
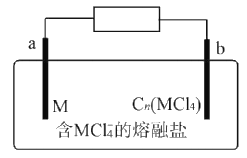
A. 放電時,MCl4-向b極遷移
B. 放電時,a極反應為M-3e-+7MCl4-=4M2Cl7-
C. 充電時,陽極反應式為Cn+MCl4-+e-=Cn(MCl4)
D. 電路上每轉移lmol電子最多有3 mol Cn(MCl4)被還原
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com