
【題目】化學科學的發展離不開物質結構的探索和研究。物質結構研究對于保護生態環境、實現社會的可持續發展有重要的意義。請回答下列問題:
(1)基態銅原子最外層電子所占用能級的電子云輪廓圖形狀為_____,基態硒原子的價電子排布圖為____。
(2)次氯酸分子的VSEPR模型名稱為_______,中心原子的雜化類型為_________。
(3)C、O、F三者的第一電離能由小到大的順序為___________。
(4)CaO的熔點比BaO(填“高”或“低”),原因是______。
(5)H2SeO4的酸性比H2SeO3強,原因是_________。
(6)與CN-互為等電子體的離子有________(寫出一種即可)。
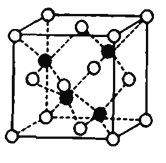
(7)Fe和S形成的某種晶胞如圖所示:其中白球表示S,黑球表示Fe,則該物質的化學式為_______.該晶胞中硫原子的配位數為_______;假設該晶胞的密度為ρg/cm3,用NA表示阿伏加德羅常數,則該晶胞中距離最近的S原子之間的距離為__________pm.
【答案】 球形 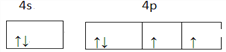 四面體型 sp3 雜化 C<O<F 高,Ca2+ 半徑比Ba2+小,CaO的晶格能比BaO大 H2SeO4 和H2SeO3 可用(HO)mSeOn, H2SeO4 中的n值大,Se的正電性高導致Se-O-H中O的電子向Se偏移,在水分子的作用下更容易電離出H + ,所以酸性更強(或者說H2SeO4 中非羥基氧數目多,所以酸性更強也得分) O22+ 或 C22- FeS 4
四面體型 sp3 雜化 C<O<F 高,Ca2+ 半徑比Ba2+小,CaO的晶格能比BaO大 H2SeO4 和H2SeO3 可用(HO)mSeOn, H2SeO4 中的n值大,Se的正電性高導致Se-O-H中O的電子向Se偏移,在水分子的作用下更容易電離出H + ,所以酸性更強(或者說H2SeO4 中非羥基氧數目多,所以酸性更強也得分) O22+ 或 C22- FeS 4 ![]() ×1010
×1010
【解析】(1)基態Cu原子核外有4個電子層,最高能層為第四層,即N層,最外層電子為4s1電子,該能層電子的電子云輪廓圖形狀為球形,硒為34號元素,有6個價電子,所以硒的價層電子排布式為4s24p4,價層電子排布圖為![]() 故答案為:球形;
故答案為:球形;![]() ;
;
(2)次氯酸分子中中心原子O有2對孤對電子和2個σ鍵,VSEPR模型為四面體,O原子采取sp3雜化,故答案為:四面體;sp3雜化;
(3)同一周期中,元素的第一電離能隨著原子序數的增大而增大,所以C、O、F元素第一電離能為C<O<F, 故答案為:C<O<F;
(4)離子晶體中離子半徑越小,則離子鍵鍵能越大,其晶體的晶格能越大,熔點越高,已知鈣離子半徑小于鋇離子半徑,所以CaO的熔點高于BaO,故答案為:高;Ca2+ 半徑比Ba2+小,CaO的晶格能比BaO大;
(5)H2SeO4中非羥基氧數目多,所以酸性更強,即H2SeO4的酸性比H2SeO3強,故答案為:H2SeO4中非羥基氧數目多,所以酸性更強;
(6)將CN-中C原子及1個負電荷換成1個N原子,可得等電子體N2,將N原子及1個負電荷換成1個O原子,可得等電子體CO,同理互為等電子體的離子有O22+或C22-等,故答案為:O22+(或C22-);
(7)黑球鐵處于晶胞內部,晶胞中含有4個Fe原子,白球S處于頂點和面心,晶胞中含有S原子數目為6×![]() +8×
+8×![]() =4,約成最簡整數比既得化學式為FeS,根據圖示,每個鐵原子周圍有四個硫原子,即晶胞中鐵原子的配位數為4,則硫原子的配位數也為4;晶胞質量為4×
=4,約成最簡整數比既得化學式為FeS,根據圖示,每個鐵原子周圍有四個硫原子,即晶胞中鐵原子的配位數為4,則硫原子的配位數也為4;晶胞質量為4×![]() g,假設該晶胞的邊長為a cm,則(a cm)3×ρ g/cm3=4×
g,假設該晶胞的邊長為a cm,則(a cm)3×ρ g/cm3=4×![]() g,則a=
g,則a=![]() ,距離最近的S原子之間距離為晶胞邊長的
,距離最近的S原子之間距離為晶胞邊長的![]() ,故S原子之間距離為
,故S原子之間距離為![]() ×
×![]() cm=
cm=![]() ×
×![]() ×1010pm,故答案為:FeS;4;
×1010pm,故答案為:FeS;4;![]() ×
×![]() ×1010。
×1010。


科目:高中化學 來源: 題型:
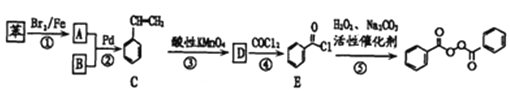
【題目】各地對食品非法添加和濫用添加劑進行了多項整治活動。其中常用的面粉增白劑過氧化苯甲酰(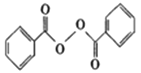 )也被禁用。下面是一種以苯為原料合成過氧化苯甲酰的流程:
)也被禁用。下面是一種以苯為原料合成過氧化苯甲酰的流程:
已知:![]()
請回答下列問題:
(1)工業上物質B主要來源于_____,物質D的名稱是_______;每個C分子中最多有____個原子共平面。
(2)結合過氧化苯甲酰結構分析,過氧化苯甲酰可以作為增白劑的原因是________。
(3)寫出反應②的化學方程式________,反應類型為________。
(4)某物質F為過氧化苯甲酰的同分異構體,同時符合下列條件的F的同分異構體有______種,請寫出其中有三種不同化學環境的氫原子的結構簡式:____________。
① 含有聯苯(![]() )結構單元.無其他環狀結構
)結構單元.無其他環狀結構
② 在一定條件下能發生銀鏡反應
③ 1mol F最多可消耗4mol NaOH
(5)請寫出以苯乙烯為原料,合成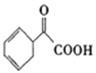 的流程,無機試劑任選,注明反應條件。____________
的流程,無機試劑任選,注明反應條件。____________
示例如下:![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】向四只盛有相同量NaOH溶液的燒杯中通入不同量的CO2氣體,在所得溶液中逐滴加入稀鹽酸至過量,并將溶液加熱,產生的CO2氣體與HCl物質的量的關系如圖:(忽略CO2的溶解和HCl的揮發),則下列分析都正確的組合是

對應圖象 | 溶液中的主要成分 | |
A | Ⅰ | NaOH、NaHCO3 |
B | Ⅱ | NaHCO3、Na2CO3 |
C | Ⅲ | NaOH、Na2CO3 |
D | Ⅳ | Na2CO3 |
A. A. B. B C. C D. D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列物質的分類中,前者是電解質,后者是非電解質的組合是( )
A.NaCl、Cl2
B.NaHCO3、蔗糖
C.Ba(OH)2、HCl
D.H2SO4、鹽酸
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一定量的CuS和Cu2S的混合物投入足量的稀HNO3溶液中,收集到NO氣體VL(標準狀況),向反應后的溶液中(存在Cu2+和SO42- )加入足量NaOH,產生藍色沉淀,過濾,洗滌,灼燒,得到CuO 12.0g.則V可能為
A. 5.5L B. 6.0L C. 8.96L D. 11.2L
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】草酸鈷是制作氧化鈷和金屬鈷的原料,一種利用含鈷廢料(主要成分Co2O3),含少量Fe2O3、ZnO、Al2O3、CaO、MgO、碳及有機物等)制取草酸鈷(CoC2O3)的工藝流程如下:

已知:ZnO與Al2O3化學性質相似,既能溶于強酸又能溶于強堿。
(1)“550℃焙燒”的目的是__________
(2)“浸出液”的主要成分是_________
(3)“鈷浸出”過程中Co3+轉化為Co2+,反應的離子方程式為___________。
(4)“凈化除雜1”過程中,先在40℃-50℃加入H2O2,其作用是_______(離子方程式表示):再升溫至80-85℃,加入Na2CO3溶液,調pH至4.5以達到凈化除雜的目的。
(5)為測定產品的純度,將1g產品用適當試劑轉化,得到草酸銨[(NH4)2C2O4]溶液。
已知NH3·H2O的Kb=1.76×10-5;H2C2O4的Ka1=5.9×l0-2,Ka2=6.4×10-5。
①判斷NH4HC2O4溶液呈________(填“酸性”、“堿性”或“中性”)。
②將草酸鈷溶液用過量稀硫酸酸化.用0.1000mol/LKMnO4溶液滴定,達到滴定終點時,共用去KMnO4溶液20.00mL,則草酸鈷樣品的純度為____%。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】關于下列圖示的說法中正確的是 ( )




① ② ③ ④
A. 用圖①所示實驗可比較硫、碳、硅三種元素的非金屬性強弱
B. 用圖②所示實驗裝置排空氣法收集CO2氣體
C. 圖③表示可逆反應CO(g)+H2O(g)![]() CO2(g)+H2(g)的△H>0
CO2(g)+H2(g)的△H>0
D. 圖④兩個裝置中通過導線的電子數相同時,消耗負極材料的物質的量也相同
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】第四周期過渡元素常與H2O、NH3等形成配合物。
(1)寫出Fe元素基態原子的價層電子排布式_______;
(2)C、N、O元素的第一電離能從大到小的順序為___(用元素符號表示);
(3)向盛有硫酸銅水溶液的試管里加入過量氨水,得到藍色溶液,銅離子形成了配位數為4的配離子,寫出該配離子的結構式為______。
(4)由C、H、O、S中任兩種元素構成甲、乙、丙三種分子,所含原子的數目依次為3、4、8,都含有18個電子。甲和乙的主要物理性質比較如下:
熔點/K | 沸點/K | 標準狀況時在水中的溶解度 | |
甲 | 187 | 202 | 2.6 |
乙 | 272 | 423 | 以任意比互溶 |
①甲分子的電子式為_________,分子構型為___________;
②1 mol乙分子含有___個σ鍵;
③丙分子的中心原子采取_______雜化軌道;
④甲和乙的相對分子質量基本相同,造成上述物理性質差異的主要原因是 ____________(結合具體物質解釋)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列氧化還原反應中,實際參加反應的氧化劑與還原劑的物質的量之比正確
①KClO3+6HCl(濃)===KCl+3Cl2↑+3H2O;1∶6
②Fe2O3+2Al![]() Al2O3+2Fe;1∶2
Al2O3+2Fe;1∶2
③SiO2+3C![]() SiC(硅為+4價)+2CO↑;1∶2
SiC(硅為+4價)+2CO↑;1∶2
④3NO2+H2O===2HNO3+NO;2∶1
A. ①③ B. ②③ C. ②④ D. ①④
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com