
【題目】將一定量純凈的氨基甲酸銨(NH2COONH4)置于特制的密閉真空容器中(假設容器體積不變,固體試樣體積忽略不計),在恒定溫度下使其達到分解平衡:NH2COONH4(s)![]() 2NH3(g)+CO2(g),下列可以判斷該分解反應已經達到化學平衡狀態的是( )
2NH3(g)+CO2(g),下列可以判斷該分解反應已經達到化學平衡狀態的是( )
A. 2v(NH3)=v(CO2) B. 密閉容器中總壓強不變
C. 密閉容器中混合氣體的平均摩爾質量不變 D. 密閉容器中氨氣的體積分數不變
 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案科目:高中化學 來源: 題型:
【題目】下列有關圖像的說法正確的是
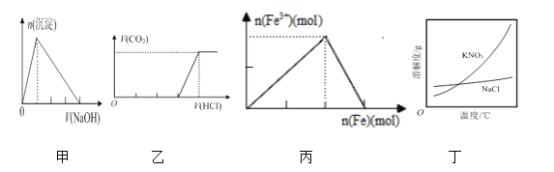
A. 圖甲表示:向某明礬溶液中滴加過量的NaOH溶液,生成沉淀的物質的量與滴加NaOH溶液體積的關系
B. 圖乙表示:向含等物質的量的NaOH和Na2CO3的混合溶液中滴加過量的稀鹽酸,生成氣體的體積與滴加HCl溶液體積的關系
C. 圖丙表示:在稀硝酸溶液中加入過量的鐵粉,溶液中Fe3+物質的量與加入鐵粉物質的量的變化關系
D. 根據圖丁,除去混在KNO3中少量的NaCl可用“蒸發濃縮、趁熱過濾”的方法
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】溴苯是不溶于水的液體,常溫下不與酸、堿反應,可用如圖裝置制取(該反應放出熱量)。制取時觀察到錐形瓶中導管口有白霧出現等現象。下列說法錯誤的是

A. 制備溴苯的反應屬于取代反應
B. 裝置圖中長直玻璃導管僅起導氣作用
C. 該反應還可能看到燒瓶中有紅色蒸汽
D. 溴苯中溶有少量的溴,可用NaOH溶液洗滌除去
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】實驗室從含碘廢液(除H2O外,含有CCl4、I2、I等)中回收碘,其實驗過程如下:

下列敘述不正確的是
A. “還原”步驟發生的反應為:SO32+I2+H2O == 2I+SO42+2H+
B. “操作X”的名稱為萃取,可在分液漏斗中進行
C. “氧化”過程中,可用雙氧水替代氯氣
D. “富集”即I2富集于有機溶劑,同時除去某些雜質離子
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列實驗操作正確的是( )
A.用向上排空氣法收集氫氣B.往燃著的酒精燈中添加酒精
C.用丁達爾現象鑒別膠體和溶液D.稀釋濃硫酸時,將水沿器壁慢慢注入酸中
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氮是動植物生長不可缺少的元素,氮在自然界中的循環對生命有重要意義。
(1)合成氨反應為N2(g)+3H2(g)![]() 2 NH3(g) H=-92.3kJ/mol,工業上為了提高H2的轉化率可采取的措施是:____________________。
2 NH3(g) H=-92.3kJ/mol,工業上為了提高H2的轉化率可采取的措施是:____________________。
A.使用催化劑 B.增大N2濃度 C增大壓強 D.升高溫度 E.及時分離生成的NH3
(2)氮的氧化物屬大氣污染物,為變廢為寶可將NO和NO2按一定的比例通入NaOH溶液使之恰好完全被吸收生成NaNO2,寫出該反應的離子方程式:_______________________________。
(3)NH3是重要的化工原料,用途廣泛,如合成尿素等。合成尿素原理分兩步:
CO2(g)+ 2 NH3(g)== NH2COONH4(s) H1=-159.5kJ/mol
NH2COONH4(s) == CO(NH2)2(s) + H2O(g) H2=+28.5kJ/mol
則2NH3(g)+ CO2(g)== CO(NH2)2(s) + H2O(g) H=____________kJ/mol
(4)向溫度為T容積為1L的剛性密閉容器中通入1molN2和3molH2發生N2(g)+3H2(g)![]() 2NH3(g)的反應。體系總壓強p與反應時間t的關系如下表:
2NH3(g)的反應。體系總壓強p與反應時間t的關系如下表:
t/h | 0 | 1 | 2 | 4 | 8 | 16 |
p/Mpa | 30.0 | 28.0 | 26.5 | 25.5 | 25.0 | 25.0 |
則H2的平衡轉化率α(H2)=_____(保留1位小數),平衡常數K=_____(用分數表示)。
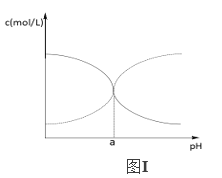
(5)現有25℃時某濃度的氯化銨溶液中NH3H2O和NH4+的濃度隨pH的變化示意圖如圖Ⅰ所示,該溫度下NH3H2O電離平衡常數為____________(用a的代數式表示)。
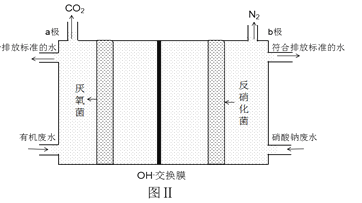
(6)利用微生物的作用將化學能轉化為電能即設計成微生物電池可用于同時處理含硝酸鈉和有機物的廢水,使NO3- 轉化為N2,裝置原理如圖Ⅱ(圖中有機物用C6H12O6表示)。寫出電極b上發生的電極反應式:_________________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某化學興趣小組為驗證SO2的還原性和Fe3+的氧化性,特邀你參與以下探究活動。
I.理論預測
該興趣小組實驗實施前進行了充分的討論交流,確定選擇SO2和FeCl3溶液的反應來探究,并預測將SO2通入FeCl3溶液中的現象。小組同學想聽聽你的
(1)確定選擇SO2和FeCl3溶液的反應而不選擇SO2和Fe(NO3)3溶液的反應來探究,你認為可能是基于什么原因作出的選擇:_______________________________________。
(2)將SO2通入FeCl3溶液中,你認為可能觀察到的現象是:______________________,你預測的理論依據是(用離子方程式表示):___________________________________。
II.實驗探究
(1)配制1mol·L-1FeCl3溶液(未用鹽酸酸化)
①下面是小組四位同學在配制溶液時的“轉移”操作,其中正確的是:_________。
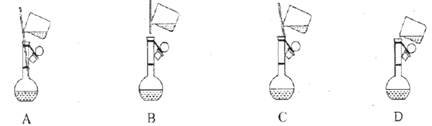
②檢測得知溶液呈酸性,其原因是:___________________________(用離子方程式表示)。
(2)將SO2通入FeCl3溶液至飽和,觀察到溶液由棕黃色變為紅棕色,并沒有觀察到預期的現象。將反應后的溶液放置12小時后又出現了預期的結果。
查閱資料得知:[Fe(HSO3)]2+為紅棕色,生成[Fe(HSO3)]2+的反應為可逆反應。請你用化學方程式解釋將SO2通入FeCl3溶液至飽和時觀察到的現象:_____________________________________。
(3)為了探究如何縮短紅棕色變為預期顏色的時間,小組繼續探究:另取少量FeCl3溶液,再通入SO2,溶液變為紅棕色,加濃HCl酸化,幾分鐘后變為預期顏色。請你推測小組在實驗方案設計中“加濃HCl酸化”的目的是:_____________________________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某化學課外活動小組通過實驗探究NO能否與Na2O2反應以及反應后的產物,該小小組同學設計了如圖所示裝置(夾持儀器、連接用的乳膠管均已省略)。

經査閱資料知:①NO是不成鹽氧化物;②2NO2+2NaOH =NaNO3+NaNO2+H2O。
回答下列問題:
(1)寫出木炭與濃硝酸反應的化學方程式:________________。
(2)為了完成實驗,選擇上圖中的裝置,其連接順序為a→_______(按氣流方向,用小寫字母表示);有同學認為該裝置存在缺陷,則該缺陷是______________。
(3)連接好儀器,_____________,裝入藥品后,要通入一段時間的氮氣,在滴入濃硝酸,點燃酒精燈,通入氮氣的主要目的是_______________。
(4)裝置E的作用是________________;能說明NO與Na2O2發生反應的實驗現象是_____________。
(5)探充NO與Na2O2反應的產物。
假設1:產物只有NaNO3;假設2:_________________;
假設3:產物為NaNO3和NaNO2的混合物。
為驗證反應產物,該小組同學準確稱取反應后的固體3.50g,用煮沸并冷卻后的蒸餾水配成100.00mL溶液,取10.00mL溶液于錐形瓶中,用0.1000mol·L-1KMnO4溶液(硫酸酸化)滴定,共消耗KMnO4溶液20mL。滴定過程中發生反應的離子方程式為___________________,反應產物中NaNO2的質量分數為_____(保留四位有效數字)
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com