
【題目】鉆鉬系催化劑主要用于石油煉制等工藝,從廢鈷鉬催化劑(主要含有![]() 、CoS和
、CoS和![]() )中回收鈷和鉬的工藝流程如圖:
)中回收鈷和鉬的工藝流程如圖:
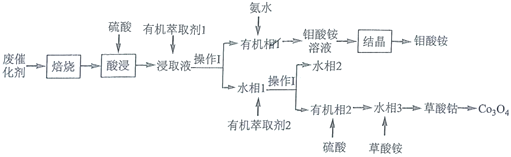
已知:浸取液中的金屬離子主要為![]() 、
、![]() 、
、![]() 。
。
(1)鉬酸銨![]() 中
中![]() 的化合價為________,
的化合價為________,![]() 在空氣中高溫焙燒產生兩種氧化物:
在空氣中高溫焙燒產生兩種氧化物:![]() 和________(填化學式)。
和________(填化學式)。
(2)為了加快酸浸速率,可采取的措施為________(任寫一條)。
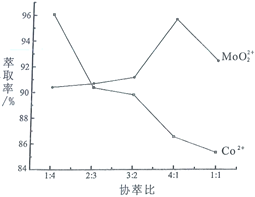
(3)若選擇兩種不同萃取劑按一定比例(協萃比)協同萃取![]() 和
和![]() ,萃取情況如圖所示,當協萃比
,萃取情況如圖所示,當協萃比![]() ________,更有利于
________,更有利于![]() 的萃取。
的萃取。
(4)操作Ⅰ的名稱為________。
(5)向有機相1中滴加氨水,發生的離子方程式為________。
(6)![]() 萃取的反應原理為
萃取的反應原理為![]() ,向有機相2中加入
,向有機相2中加入![]() 能進行反萃取的原因是________(結合平衡移動原理解釋)。
能進行反萃取的原因是________(結合平衡移動原理解釋)。
(7)水相2中的主要溶質除了![]() ,還有________(填化學式)。
,還有________(填化學式)。
(8)![]() 可用作電極,若選用
可用作電極,若選用![]() 電解質溶液,通電時可轉化為
電解質溶液,通電時可轉化為![]() ,其電極反應式為________。
,其電極反應式為________。
【答案】![]()
![]() 攪拌
攪拌 ![]() 分液
分液 ![]() 根據
根據![]() 可知,加入
可知,加入![]() ,
,![]() 增大,平衡向左移動
增大,平衡向左移動 ![]()
![]()
【解析】
從廢鈷鉬催化劑(主要含有![]() 、CoS和
、CoS和![]() )經過焙燒后,得到
)經過焙燒后,得到![]() ,CoO和二氧化硫,加入硫酸后,浸取液中的金屬離子主要為
,CoO和二氧化硫,加入硫酸后,浸取液中的金屬離子主要為![]() 、
、![]() 、
、![]() ,經過萃取和分液得到有機相1和水相1,有機相1中含有
,經過萃取和分液得到有機相1和水相1,有機相1中含有![]() ,加入氨水后得到鉬酸銨溶液,經結晶后得到鉬酸銨;水相1中含有
,加入氨水后得到鉬酸銨溶液,經結晶后得到鉬酸銨;水相1中含有![]() 、
、![]() ,SO42-,經萃取分液后,水相2中含有
,SO42-,經萃取分液后,水相2中含有![]() 和
和![]() ,有機相2中含有
,有機相2中含有![]() 、SO42-,加入硫酸后,得到水相3,加入草酸銨,得到草酸鈷,加熱草酸鈷可以得到四氧化三鈷,據此分析解答。
、SO42-,加入硫酸后,得到水相3,加入草酸銨,得到草酸鈷,加熱草酸鈷可以得到四氧化三鈷,據此分析解答。
(1)![]() 中,銨根離子為+1價,O為-2價,所有元素的化合價之和為0,Mo的化合價為+6,
中,銨根離子為+1價,O為-2價,所有元素的化合價之和為0,Mo的化合價為+6,![]() 和氧氣反應的化學方程式為:2
和氧氣反應的化學方程式為:2![]() +7O2=2
+7O2=2![]() +4SO2,可知生成物有二氧化硫和
+4SO2,可知生成物有二氧化硫和![]() 兩種氧化物;
兩種氧化物;
(2)為了加快酸浸速率,可采取的措施為攪拌,可以增大接觸面積;
(3)根據圖像,找到![]() 最多,
最多,![]() 較少的協萃比為4:1;
較少的協萃比為4:1;
(4)操作1是將有機相和水相分開,是分液;
(5)有機相1中含有![]() ,加入氨水后得到鉬酸銨溶液,化學方程式為
,加入氨水后得到鉬酸銨溶液,化學方程式為![]() ;
;
(6)根據![]() 可知,加入
可知,加入![]() ,
,![]() 增大,平衡向左移動,能進行反萃取;
增大,平衡向左移動,能進行反萃取;
(7)水相1中含有![]() 、
、![]() ,SO42-,經萃取分液后,水相2中含有
,SO42-,經萃取分液后,水相2中含有![]() 和
和![]() ;
;
(8)![]() 可以表示成
可以表示成![]() ,在堿性條件下可發生氧化反應,生成
,在堿性條件下可發生氧化反應,生成![]() ,電極反應為
,電極反應為![]() 。
。


 備戰中考寒假系列答案
備戰中考寒假系列答案科目:高中化學 來源: 題型:
【題目】下列說法不正確的是( )
A.乙醛和乙烯均能使溴水褪色,兩者的反應原理不同
B.淀粉和纖維素均可以制酒精,酒精在某種微生物作用下發生氧化反應得到醋酸
C.蛋白質溶液在強酸、強堿、紫外線和加熱條件下都能發生變性
D.甲苯的一氯代物有4種,甲苯與氫氣加成后的產物的一氯代物也只有4種
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】實驗室用乙酸和乙醇在濃硫酸作用下制取乙酸乙酯的裝置如圖。下列說法正確的是
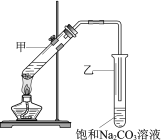
A. 向甲試管中先加濃硫酸,再加乙醇和乙酸
B. 乙試管中導管不伸入液面下,是為了防止倒吸
C. 加入過量乙酸,可使乙醇完全轉化為乙酸乙酯
D. 實驗完畢,可將乙酸乙酯從混合物中過濾出來
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下表列出了①~⑨九種元素在周期表中的位置。
族 | ⅠA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | ⑤ | ||||
3 | ⑥ | ⑦ | ⑧ | ⑨ | ||||
請按要求回答下列問題:
(1)①~⑨九種元素中非金屬性最強的是________(填元素符號)。
(2)元素⑧的原子結構示意圖是_________;由①、④、⑥三種元素組成的化合物,其電子式是_________。
(3)元素②、⑧的氣態氫化物的穩定性較強的是________________(填化學式);元素③、⑨的最高價氧化物對應的水化物的酸性較強的是________________(填化學式)。
(4)③、④span>、⑧三種元素的原子半徑由大到小的順序是________________(填元素符號)。
(5)元素⑤、⑥組成的化合物的化學鍵類型是________________________。
(6)元素⑥的最高價氧化物對應的水化物與元素⑦的最高價氧化物對應的水化物反應的離子方程式是________________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】1,2-二溴乙烷可作汽油抗爆劑的添加劑,常溫下它是無色液體,不溶于水,易溶于醇等有機溶劑。實驗室制備1,2-二溴乙烷的反應原理如下:
CH3CH2OH![]() CH2=CH2+H2O
CH2=CH2+H2O
CH2=CH2+Br2→BrCH2CH2Br
已知:①乙醇在濃硫酸存在下在140℃脫水生成乙醚
2CH3CH2OH![]() CH3CH2OCH2CH3+H2O
CH3CH2OCH2CH3+H2O
②實驗中常因溫度過高而使乙醇和濃硫酸反應生成少量SO2和CO2,用12.0g溴和足量的乙醇制備1,2-二溴乙烷,實驗裝置如圖所示:
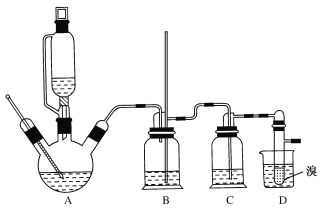
有關數據列表如下:
類別 | 乙醇 | 1,2-二溴乙烷 | 乙醚 |
狀態 | 無色液體 | 無色液體 | 無色液體 |
密度/g·cm-3 | 0.79 | 2.2 | 0.71 |
沸點/℃ | 78.5 | 132 | 34.6 |
熔點/℃ | -130 | 9 | -116 |
回答下列問題:
(1)在此制備實驗中,A中按最佳體積比3﹕1加入乙醇與濃硫酸后,A中還要加入幾粒碎瓷片,其作用是___。要盡可能迅速地把反應溫度提高到170℃左右,其最主要目的是___。
(2)裝置B的作用是作安全瓶,瓶中盛水,除了可以防止倒吸以外,還可判斷裝置是否堵塞,若堵塞,B中現象是____。
(3)在裝置C中應加入NaOH溶液,其目的是____。
(4)裝置D中小試管內盛有液溴,判斷該制備反應已經結束的最簡單方法是___。
(5)將1,2—二溴乙烷粗產品置于分液漏斗中加水,振蕩后靜置,產物應在___層(填“上”或“下”)。若產物中有少量未反應的Br2,最好用___洗滌除去;若產物中有少量副產物乙醚,可用____(填操作方法名稱)的方法除去。
(6)反應過程中應用冷水冷卻裝置D,其主要目的是乙烯與溴反應時放熱,冷卻可避免溴的大量揮發;但又不能過度冷卻(如用冰水),其原因是___。
(7)若實驗結束后得到9.4g產品,1,2—二溴乙烷的產率為___。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】電動汽車已逐漸走入人們的生活,一些電動汽車動力使用的是鈷酸鋰(LiCoO2)電池,其工作原理如圖,A極材料是金屬鋰和石墨的復合材料(石墨作為金屬鋰的載體),電解質為一種能傳導Li+的高分子材料。隔膜只允許特定的離子通過,電池反應式為LixC6+Li1xCoO2![]() C6+LiCoO2,下列說法不正確的是
C6+LiCoO2,下列說法不正確的是
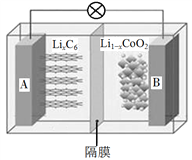
A. 該隔膜只允許Li+通過,放電時Li+從左邊移向右邊
B. 充電時,B電極與電源正極相連
C. 電池放電時,負極的電極反應式為LixC6xe![]() xLi++C6
xLi++C6
D. 廢舊鈷酸鋰電池進行“放電處理”讓Li+進入石墨中而有利于回收
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】通常監測SO2含量是否達到排放標準的反應原理是SO2+H2O2+BaCl2=BaSO4↓+2HCl。設NA表示阿伏加德羅常數的值,下列說法正確的是( )
A.0.1molBaCl2晶體中所含離子總數為0.2NA
B.25℃時,pH=1的HC1溶液中含有H+的數目為0.1NA
C.17gH2O2中含有非極性鍵數目為0.5NA
D.生成2.33gBaSO4沉淀時,轉移電子數目為0.01NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在常溫下,有下列五種溶液:
①0.1mol/LNH4Cl②0.1mol/LCH3COONH4③0.1mol/LNH4HSO4
④0.1mol/LNH4HCO3 ⑤0.1mol/LNaHCO3
請根據要求填寫下列空白:
(1)溶液①呈 ______ 性(填“酸”、“堿”或“中”),其原因是: ______ (用離子方程式表示)
(2)溶液⑤呈 ______ 性(填“酸”、“堿”或“中”),其原因是: ______ (用離子方程式表示)
(3)比較溶液①、③中c(NH4+)的大小關系是① ______ ③(填“>”、“<”或“=”)
(4)常溫下,測得溶液②的pH=7,則CH3COO-的水解程度 ______ NH4+的水解程度(填“>”、“<”或“=”),CH3COO-與NH4+濃度的大小關系是:c(CH3COO-)_____c(NH4+)(填“>”、“<”或“=”)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某溫度時,兩個恒容密閉容器中僅發生反應2NO2(g)2NO(g) +O2(g) ΔH > 0。實驗測得:υ正(NO2)=k正c2(NO2),υ逆(NO)=k逆c2(NO)·c(O2),k正、k逆為化學反應速率常數,只受溫度影響。
容器 編號 | 起始濃度(mol·L1) | 平衡濃度(mol·L1) | ||
c(NO2) | c(NO) | c(O2) | c(O2) | |
Ⅰ | 0.6 | 0 | 0 | 0.2 |
Ⅱ | 0.6 | 0.1 | 0 | |
下列說法不正確的是
A.Ⅰ中NO2的平衡轉化率約為66.7%
B.Ⅱ中達到平衡狀態時,c(O2)<0.2mol·L1
C.該反應的化學平衡常數可表示為![]()
D.升高溫度,達到平衡狀態時 Ⅰ中c(O2)<0.2mol·L1
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com