
【題目】設NA為阿伏加德羅常數的值,下列說法正確的是
A.1 mol·L-1AlCl3溶液中含有的Al3+數目小于NA
B.標準狀況下,11 g 3H216O中含有的質子數目為6NA
C.1 mol Li2O和Na2O2的混合物中含有的離子總數大于3NA
D.常溫常壓下,4.6 g NO2所含的氮原子數目為0.1NA
科目:高中化學 來源: 題型:
【題目】下列事實與原因對應關系不正確的是
A | B | C | D | |
物質 |
Na2FeO4 |
海水稻 |
金屬銅 |
碳酸鈉 |
事實 | 用于自來水凈水消毒 | 海水稻的秸桿可以燃燒發電 | Cu作原電池的電極 | 制革工業中原料皮的脫脂 |
主要原因 | Na2FeO4有強氧化性且能在水中產生膠體 | 稻子的秸桿中蘊含生物質能 | Cu能導電且質穩定 | Na2CO3穩定性強 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知元素的電負性和原子半徑一樣,也是元素的基本性質。下表給出14種元素的電負性:
元素 | AL | B | Be | C | Cl | F | Li | Mg | N | Na | O | P | S | Si |
電負性 | 1.5 | 2.0 | 1.5 | 2.5 | 3.0 | 4.0 | 1.0 | 1.2 | 3.0 | 0.9 | 3.5 | 2.1 | 2.5 | 1.8 |
試結合元素周期律相關知識完成下列問題。
(1)根據上表給出的數據,可推知元素的電負性具有的變化規律是__________ (從電負性與結構的關系考慮)。
(2)請預測Br與I元素電負性的大小關系:_________ 。
(3)經驗規律告訴我們:當成鍵的兩原子相應元素的電負性差值大于1.7時,一般為離子鍵,而小于1.7時,一般為共價鍵。試推斷![]() 中化學鍵的類型是 ___________
中化學鍵的類型是 ___________
(4)預測元素周期表中電負性最小的元素是_____ (放射性元素除外)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知w g液態苯(C6H6)完全燃燒生成2 mol CO2氣體和1 mol液態水,并放出m kJ的熱量,下列能正確表示苯燃燒熱的熱化學方程式的是( )
A. 2C6H6(l)+15O2(g)===12CO2(g)+6H2O(l) ΔH=-2m kJ·mol-1
B. ![]() C6H6(l)+
C6H6(l)+![]() O2(g)===2CO2(g)+H2O(l) ΔH=-m kJ·mol-1
O2(g)===2CO2(g)+H2O(l) ΔH=-m kJ·mol-1
C. C6H6(l)+![]() O2(g)===6CO2(g)+3H2O(l) ΔH=-m kJ·mol-1
O2(g)===6CO2(g)+3H2O(l) ΔH=-m kJ·mol-1
D. C6H6(l)+![]() O2(g)===6CO2(g)+3H2O(l) ΔH=-3m kJ·mol-1
O2(g)===6CO2(g)+3H2O(l) ΔH=-3m kJ·mol-1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知1 g氫氣完全燃燒生成水蒸氣時放出熱量121 kJ,且氧氣中1 mol O=O鍵完全斷裂時吸收熱量496 kJ,水蒸氣中1mol H-O鍵形成時放出熱量463 kJ,則氫氣中1mol H-H鍵斷裂時吸收熱量為
A.920 kJB.557 kJC.436 kJD.188 kJ
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】K層有_____________個能級,用符號表示為_____________;L層有_____________個目自級,用符號表示為_____________;M層有_____________個能級,用符號表示為_____________。由此可推知第n(n為正整數)電子層最多可能有_____________個能級,當![]() 時,能量最低的兩個能級的符號分別為_____________,它們的原子軌道形狀分別為_____________、_____________。
時,能量最低的兩個能級的符號分別為_____________,它們的原子軌道形狀分別為_____________、_____________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖為周期表中部分元素某種性質(X值)隨原子序數變化的關系。
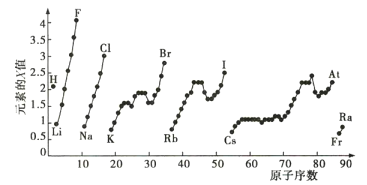
(1)短周期中原子核外p能級上電子數與s能級上電子總數相等的元素是___(填元素符號)。
(2)同主族內不同元素的X值變化的特點是___;同周期內,隨著原子序數的增大,X值的變化總趨勢是___。周期表中X值的這種變化特點體現了元素性質的___變化規律。
(3)X值較小的元素集中在元素周期表的___(填序號,下同)。
a.左下角 b.右上角 c.分界線附近
(4)下列說法正確的是___。
a.X值可反映元素最高正化合價的變化規律
b.X值可反映原子在分子中吸引電子的能力
c.X值的大小可用來衡量元素金屬性和非金屬性的強弱
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】聚維酮碘的水溶液是一種常見的碘伏類緩釋消毒劑,聚維酮通過氫鍵與 HI3形成聚維酮碘,其結構表示如圖,(圖中虛線表示氫鍵)下列說法不正確的是
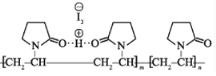
A.聚維酮碘是一種水溶性物質
B.聚維酮的單體是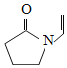
C.聚維酮分子由(m+n)個單體聚合而成
D.聚維酮在一定條件下能發生水解反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】非金屬元素在化學中具有重要地位,請回答下列問題:
(1)氧元素的第一電離能比同周期的相鄰元素要小,理由________。
(2)元素X與硒(Se)同周期,且該周期中X元素原子核外未成對電子數最多,則X為_____(填元素符號),其基態原子的電子排布式為_______。
(3)臭齅排放的臭氣主要成分為3-MBT-甲基2丁烯硫醇,結構簡式為(![]() )1mol 3-MBT中含有
)1mol 3-MBT中含有![]() 鍵數目為_______NA(NA為阿伏伽德羅常數的值)。該物質沸點低于(CH3)2C=CHCH2OH,主要原因是_______。
鍵數目為_______NA(NA為阿伏伽德羅常數的值)。該物質沸點低于(CH3)2C=CHCH2OH,主要原因是_______。
(4)PCl5是一種白色晶體,熔融時形成一種能導電的液體測得其中含有一種正四面體形陽離子和一種正八面體形陰離子;熔體中P-Cl的鍵長只有198pm和206pm兩種,試用電離方程式解釋PCl5熔體能導電的原因_________,正四面體形陽離子中鍵角大于PCl3的鍵角原因為__________,該晶體的晶胞如圖所示,立方體的晶胞邊長為a pm,NA為阿伏伽德羅常數的值,則該晶體的密度為_______g/cm 3
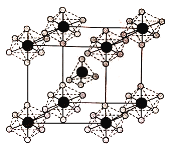
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com