
【題目】某研究小組為探討反應A(g)+2B(g) ![]() 2C(g)+D(s)在催化劑存在的條件下對最適宜反應條件進行了一系列的實驗,并根據所得實驗數據繪制出下圖:圖中C%為反應氣體混合物中C的體積百分含量(所有實驗的反應時間相同)。
2C(g)+D(s)在催化劑存在的條件下對最適宜反應條件進行了一系列的實驗,并根據所得實驗數據繪制出下圖:圖中C%為反應氣體混合物中C的體積百分含量(所有實驗的反應時間相同)。
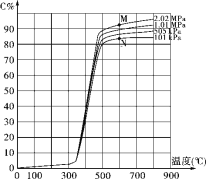
(1)該反應的反應熱為ΔH_____0(填“>”、“<”或“=”)。
(2)點M和點N處平衡常數K的大小是:KM______KN(填“>”、“<”或“=”)。
(3)工業上進行該反應獲得產品C的適宜條件是:度為______℃,選擇該溫度的理由是________________,壓強為______,選擇該壓強的理由是__________________ 。
(4)試解釋圖中350℃前C%變化平緩而后急劇增大、500℃以后又緩慢增加的可能原因:_____________。
【答案】> = 500 低于500℃時,C%值太小,高于500℃時C%隨溫度的升高而增大的幅度不明顯,但由于升溫帶來的燃料及設備成本要求會明顯增加 101kPa 隨著壓強的增大,C%的增大幅度并不明顯,而由于壓強增大而帶來的動力,設備成本的大幅度增加,故選擇常壓 該反應需要在特定的催化劑作用下才能順利進行,而該催化劑只有在350℃以上才能體現催化活性并在500℃左右時催化效果最好,500℃以上的變化為溫度變化導致平衡移動的情形
【解析】
試題(1)從圖像看出,隨著溫度升高,C%增大,說明溫度升高平衡向正反應方向移動,則反應是吸熱反應,所以△H>0。(2)平衡常數只和溫度有關,M、N兩點所處的溫度相同,故KM=KN。(3)獲得產品C 的適宜條件是:溫度為500℃,因為低于500℃時,C%值太小,高于500℃時C%隨溫度的升高而增大的幅度不明顯,但由于升溫帶來的燃料及設備成本要求會明顯增加。壓強選擇:101k Pa,是因為:隨著壓強的增大,C%的增大幅度并不明顯,而由于壓強增大而帶來的動力,設備成本的大幅度增加,故選擇常壓。(4)350℃前C%變化平緩而后急劇增大、500℃以后又緩慢增加的可能原因是:該反應需要在特定的催化劑作用下才能順利進行,而該催化劑只有在350℃以上才能體現催化活性并在500℃左右時催化效果最好,500℃以上的變化為溫度變化導致平衡移動的情形。


 黎明文化寒假作業系列答案
黎明文化寒假作業系列答案科目:高中化學 來源: 題型:
【題目】下列各圖象能正確反映其對應操作中各量變化關系的是 ( )
A.  用一定質量的高錳酸鉀加熱制氧氣
用一定質量的高錳酸鉀加熱制氧氣
B.  向一定質量的石灰石中加入過量的稀鹽酸
向一定質量的石灰石中加入過量的稀鹽酸
C.  向一定溫度下的飽和氫氧化鈣溶液中不斷加入氧化鈣固體
向一定溫度下的飽和氫氧化鈣溶液中不斷加入氧化鈣固體
D.  分別向等質量的鋁和鐵中加入溶質質量分數相同的稀鹽酸至過量
分別向等質量的鋁和鐵中加入溶質質量分數相同的稀鹽酸至過量
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)在25℃、101 kPa下,1 g甲醇燃燒生成CO2和液態水時放熱22.68 kJ,則該反應的燃燒熱的熱化學方程式應為_________________。
(2)化學反應的焓變與反應物和生成物的鍵能有關。所謂鍵能就是:在101kPa、298 K時,斷開1 mol氣態AB為氣態A、氣態B時過程的焓變,用ΔH298(AB)表示;斷開化學鍵時ΔH>0[如H2(g)=2H(g) ΔH= +436 kJ·mol-1],形成化學鍵時ΔH<0[如2H(g)=H2(g) ΔH= - 436 kJ·mol-1]。
已知:H2(g)+Cl2(g)=2HCl(g) ΔH= -185 kJ·mol-1 ΔH298(H2)=+ 436 kJ·mol-1 ,ΔH298(Cl2)= +247 kJ·mol-1則ΔH298(HCl)=__________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】熱值是指一定條件下單位質量的物質完全燃燒所放出的熱量。已知H2(g)、CO(g)和CH3OH(l)的熱值分別為143 kJ· g-1、10 kJ·g-1和23 kJ·g-1。請回答下列問題:
(1)寫出CO燃燒反應的熱化學方程式為__________________________________________。
(2)表示甲醇燃燒熱的熱化學方程式為__________________________________________。
(3)甲醇不完全燃燒生成一氧化碳和液態水的熱化學方程式為__________________________。
(4)白磷與氧可發生如下反應:P4(g)+5O2(g)![]() P4O10(g)。已知斷裂下列化學鍵需要吸收的能量分別為:P—P a kJ/mol、P—O b kJ/mol、P=O c kJ/mol、O=O d kJ/mol根據圖示的分子結構和有關數據計算該反應的反應熱_____________。
P4O10(g)。已知斷裂下列化學鍵需要吸收的能量分別為:P—P a kJ/mol、P—O b kJ/mol、P=O c kJ/mol、O=O d kJ/mol根據圖示的分子結構和有關數據計算該反應的反應熱_____________。
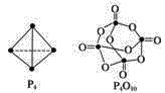
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在一定溫度下,醋酸溶液中存在電離平衡:CH3COOH![]() CH3COO- + H+
CH3COO- + H+
(1)某溫度時,0.1 mol·L-1的醋酸溶液中的c(H+) 與0.01 mol·L-1的醋酸溶液中的c(H+)的比值______(填“大于”“小于”或“等于”)10。
(2)已知:25 ℃時,該電離平衡的平衡常數為1.75×10-5。
①求該溫度時,a mol·L-1的醋酸溶液中c1(H+)=________________mol·L-1 (用含a的代數式表示)。[提示:此時電離度比較小,進行簡化計算,平衡時c(CH3COOH)可用初始濃度代替,水電離出的c(H+)、c(OH-)忽略不計,下同]
②若該溫度時向該溶液中加入一定量的CH3COONH4(假設溶液體積不變),使溶液中c(CH3COO-)為b mol·L-1,則此時c2(H+)=____________________mol·L-1(用含a、b的代數式表示)。
③c1(H+)________(填“大于”“小于”或“等于”)c2(H+)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一定條件下,發生反應:①M(s)+N(g) R(g) ΔH= - Q1 kJ/mol
②2 R(g)+N(g) 2T(g) ΔH= - Q2 kJ/mol(已知Q1、Q2、Q3均為正值)
下列說法正確的是
A. 1molR(g)的能量總和大于1molM(s)與1molN(g)的能量總和
B. 將2mol R(g)與1molN(g)充分混合,在一定條件下充分反應,放出熱量Q2 kJ
C. 當1molM(s)完全轉化為T(g)時(假定無熱量損失),放出熱量(Q1+0.5Q2)kJ
D. M(g)+N(g) R(g) ΔH= - Q3 kJ/mol,則Q3 < Q1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】溫度為T1時,將氣體X和氣體Y各1.6mol充入10L恒容密閉容器中,發生反應X(g)+Y(g)![]() 2Z(g),一段時間后達到平衡。反應過程中測定的數據如表:下列說法正確的是
2Z(g),一段時間后達到平衡。反應過程中測定的數據如表:下列說法正確的是
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 1.2 | 1.1 | 1.0 | 1.0 |
A. 反應0~4 min的平均速率υ(Z)=0.25 mol/(Lmin)
B. T1時,反應的平衡常數K1=1.2
C. 其他條件不變,9 min后,向容器中再充入1.6 molX,平衡向正反應方向移動,再次達到平衡時X的濃度減小,Y的轉化率增大
D. 其他條件不變,降溫到T2達到平衡時,平衡常數K2=4,則此反應的△H<0
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】防治霧霾天氣的主要措施有機動車臨時交通管制、工礦企業停業限產、揚塵污染控制等。
(1)PM2.5是環保部門監測空氣質量的重要指標。將某PM2.5樣本用蒸餾水處理制成待測試樣,測得試樣中無機離子(OH-忽略不計)的種類和平均濃度如下表:
離子種類 | Na+ | NH4+ | SO42- | NO3- |
濃度(mol/L) | 2.0×10-6 | 2.8×10-5 | 3.5×10-5 | 6.0×10-5 |
則試樣的pH為________________________。
(2)一定條件下,以CO和H2合成清潔能源CH3OH,其熱化學方程式為CO(g)+2H2(g) CH3OH(g) ΔH,CO的平衡轉化率與溫度、壓強的關系如圖所示:

①該可逆反應的ΔH__________0(填“>”“<”或“=”)。A、B、C三點對應的平衡常數KA、KB、KC的大小關系是______________。壓強:p1__________p2(填“>”“<”或“=”)。在T1條件下,由D點到B點過程中,正、逆反應速率之間的關系:v(正)___________v(逆)(填“>”“<”或“=”)。
②若在恒溫恒容條件下進行上述反應,能表示該可逆反應達到平衡狀態的是_________(填字母)。
A.CO的體積分數保持不變
B.容器內混合氣體的密度保持不變
C.容器內混合氣體的平均摩爾質量保持不變
D.單位時間內消耗CO的濃度等于生成CH3OH的濃度
③向恒壓密閉容器中充入2 mol CO和4 mol H2,在p2、T2條件下達到平衡狀態C點,此時容器容積為2 L,則在該條件下反應的平衡常數K為_________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】分別調節0.01mol·L-1HCOOH溶液、0.01mol·L-1氨水的pH,系統中微粒濃度的負對數值(-lgc)與pH的關系分別如下圖所
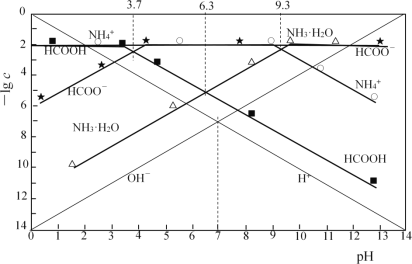
下列說法錯誤的是
A. 25℃時,NH3·H2O![]() NH4++OH-的lgK=-4.7
NH4++OH-的lgK=-4.7
B. 25℃時,0.01mol·L-1HCOOH溶液的pH為3.7
C. HCOONa溶液中加入NH4Cl至溶液呈中性:c(Cl-)>c(Na+)>c(HCOO-)
D. HCOONa溶液中加入KHSO3至溶液呈中性:c(HCOOH) +c(H2SO3) = c(SO32-)
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com