
【題目】在一定溫度下,反應A2(g)+B2(g)![]() 2AB(g)達到平衡的標志是( )
2AB(g)達到平衡的標志是( )
A. 單位時間內生成n molA2同時生成n molAB
B. 容器內的總物質的量不隨時間變化
C. 單位時間內生成2n molAB的同時生成n molB2
D. 單位時間內生成n molA2的同時生成n molB2
科目:高中化學 來源: 題型:
【題目】用含少量鎂粉的鋁粉制取純凈的氫氧化鋁,下列操作步驟中最恰當的組合是( )
①加鹽酸溶解 ②加燒堿溶液溶解 ③過濾 ④通入過量CO2生成Al(OH)3沉淀 ⑤加入鹽酸生成Al(OH)3沉淀 ⑥加入過量燒堿溶液
A.②③④③B.①⑥⑤③C.②③⑤③D.①③⑤③
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】羰基硫(O=C=S)廣泛存在于以煤為原料的各種化工原料氣中,能引起催化劑中毒、化學產品質量下降和大氣污染。羰基硫的氫解反應和水解反應是兩種常用的脫硫方法,其反應式分別為:
①氫解反應:COS(g)+H2(g)![]() H2S(g)+CO(g) △H1=+7kJ/mol
H2S(g)+CO(g) △H1=+7kJ/mol
②水解反應:COS(g)+H2O(g)![]() H2S(g)+CO2(g) △H2
H2S(g)+CO2(g) △H2
已知反應中相關的化學鍵鍵能數據如下:
化學鍵 | C=O(CO2) | C=O(COS) | C=S | H-S | H-O |
E/kJ·mol-1 | 803 | 742 | 577 | 339 | 465 |
回答下列問題:
(1)在以上脫除COS的反應中,若某反應有1mol電子發生轉移,則該反應吸收的熱量為____kJ。
(2)已知熱化學方程式CO(g)+H2O(g)![]() H2(g)+CO2(g) △H3,則△H3=_____kJ/mol。
H2(g)+CO2(g) △H3,則△H3=_____kJ/mol。
(3)某溫度下,在某密閉容器中進行COS的氫解反應
①當反應達到限度后,增大容器的體積,則正反應速率_____(填“增大”“減小”或“不變”);
②當容器體積不變時,若起始時充入COS和H2的體積比為1:2,下列情形能表明反應達到平衡狀態的是______。
a.氣體密度不變 b.COS與H2濃度比不變
c.混合氣體的平均相對分子質量不變 d.COS體積分數不變
③當容器體積不變時,若COS和H2的起始物質的量比為1:a,平衡后COS和H2的物質的量比為1:10a,則此溫度下H2平衡轉化率為______(用含a的式子表示)。
(4)羰基硫的氫解或水解反應能否設計成原電池_____(能或否),理由是________。
(5)用金屬儲氫材料(MH)、鉑(Pt)、硫酸溶液組成的原電池可以使羰基硫脫硫處理。
①原電池的負極材料是____(填化學式)。
②寫出原電池的正極反應式_________,正極周圍溶液pH______(填“增大”“減小”或“不變”)。
③原電池工作時,硫酸溶液的作用是___________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】化合物 J 是某種解熱鎮痛藥,以 A 為原料的工業合成路線如下圖所 示:

已知
分子式 B: C8H8O2 C:C8H7NO4 D:C6H5NO3 E :C6H7NO F:C9H11NO2 H:C6H 7O3
(1)寫出同時符合下列條件的 F 的所有同分異構體的結構簡式_____
①屬 a—氨基酸:(a 碳上須含有氫原子) ② NMR 譜表明分子中含有苯環
(2)下列說法不正確的是_____
A.化合物 C 中含氧官能團有兩種
B.化合物 E 既可以與 NaOH 反應又可以與 HCl 反應
C.化合物 F 能與 FeCl3 發生顯色反應
D.化合物 J 的分子式為 C18H15NO5
(3)設計 G→H 的合成路線(用流程圖表示,無機試劑任選)_____
(4)寫出 I+F→J 的化學方程式_____
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】可再生能源和清潔能源將成為新能源的主力軍,下列關于能源的敘述正確的是
A.化石燃料是可再生能源B.氫能、太陽能是清潔能源
C.化石燃料都是清潔能源D.海洋能、地熱能是不可再生的清潔能源
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】Ⅰ.分別按圖甲、乙所示裝置進行實驗,圖中兩個燒杯里的溶液為同濃度的稀硫酸,乙中G為電流計,請回答下列問題:
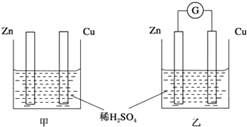
(1)以下敘述中,正確的是____。
A.甲中鋅片是負極,乙中銅片是正極
B.兩燒杯中銅片表面均有氣泡產生
C.兩燒杯中溶液pH均增大
D.產生氣泡的速度甲中比乙中慢
E.乙的外電路中電流方向Zn→Cu
(2)變化過程中能量轉化的形式主要是:甲為___________;乙為_________。
(3)在乙實驗中,如果把硫酸換成硫酸銅溶液,請寫出銅電極的電極反應方程式:___________________________________。
Ⅱ.氫氧燃料電池,是一種高效無污染的清潔電池它分堿性(用KOH做電解質)和酸性(用硫酸做電解質)氫氧燃料電池。
(1)如果是堿性燃料電池則負極反應方程式是:____________________。
(2)如果是酸性燃料電池則正極反應方程式是:___________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氧化還原反應在生產、生活中應用廣泛,用所學知識回答問題:
(1)聯氨是一種可燃性液體,可用作火箭燃料。已知32.0gN2H4和H2O2反應生成氮氣和水(氣態),放出熱量642kJ,該反應的熱化學方程式是:____________。
(2)取300mL0.2mo/L的KI溶液與一定量的KMnO4溶液恰好反應,生成等物質的量I2和KIO3,則消耗KMnO4的物質的量是__________mol。
(3)以甲醇(CH3OH) 為燃料的電池中,電解質溶液為堿性,則負極的電極反應為:__________。
(4)二氧化氯是目前國際上公認的最新一代的高效、廣譜、安全的殺菌、保鮮劑。我國科學家研發了用氯氣氧化亞氯酸鈉(NaClO2) 固體制備二氧化氯的方法,其化學方程式為___________。
(5)在Fe(NO3)3溶液中加入Na2SO3溶液,溶液先由棕黃色變為淺綠色,過一會又變為棕黃色,溶液先變為淺綠色的離子方程式是__________,又變為棕黃色的原因是__________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】除去NaHCO3溶液中混有的Na2CO3,下列方法中應采用的是 ( )
A. 加入過量的HCl溶液
B. 通入過量的CO2氣體
C. 加入過量的Ca(HCO3)2溶液
D. 將溶液進行加熱
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com